题目内容
【题目】某化学兴趣小组,为了测定铜锌合金样品中锌的含量,称取样品20克于烧杯中,向其中加入50克稀硫酸至恰好完全反应,反应后烧杯中物质的总质量为69.8克,求:
(1)样品中锌的质量分数?
(2)稀硫酸溶质的质量分数?
【答案】(1)32.5%;(2)19.6%
【解析】
铜锌合金中,只有锌能和稀硫酸反应生成硫酸锌和氢气。铜不与稀硫酸反应。
(1)根据质量守恒定律可知,化学反应前后,物质的质量相等。则通过题意可知,减少的质量为生成的氢气的质量,即:20g+50g-69.8g=0.2g。
设锌的质量为x,参加反应的硫酸的质量为y
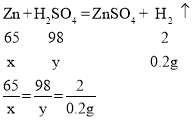
解得x=6.5g,y=9.8g
所以样品中,锌的质量分数为:![]()
(2)根据(1)可知,50g稀硫酸溶液中,硫酸溶质的质量为9.8g,则稀硫酸的溶质质量分数为:![]()

练习册系列答案
相关题目
【题目】某食用碱的主要成分是 ![]() ,其中含有少量的 NaCl,小明同学为测定该食用碱中
,其中含有少量的 NaCl,小明同学为测定该食用碱中 ![]() 的质量分数,他进行了以下实验,取60g食用碱,加水配成400g的溶液,把溶液平均分为四份,然后分别加入一定质量分数的
的质量分数,他进行了以下实验,取60g食用碱,加水配成400g的溶液,把溶液平均分为四份,然后分别加入一定质量分数的![]() 溶液,实验数据见表:
溶液,实验数据见表:
实验一 | 实验二 | 实验三 | 实验四 | |
食用碱溶液的质量 | 100g | 100g | 100g | 100g |
加入 | 20g | 40g | 60g | 80g |
生成沉淀的质量 | 3g | 6g | m | 10g |
请分析表中数据并计算回答。
(1)m=______;
(2)该60g食用碱配成的溶液与足量![]() 溶液反应,最多生成沉淀质量为_______g;
溶液反应,最多生成沉淀质量为_______g;
(3)该食用碱中 ![]() 的质量分数是多少_______?(写出计算过程,答案精确到
的质量分数是多少_______?(写出计算过程,答案精确到 ![]() )
)