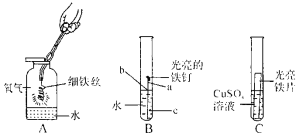
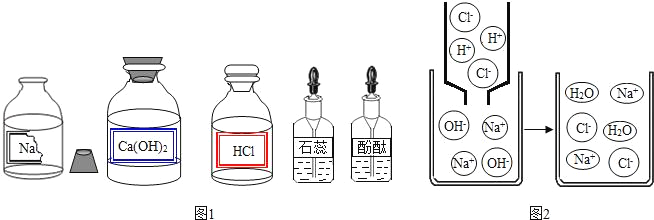
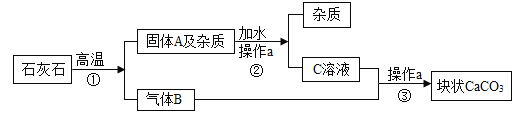
题目内容
【题目】向盛有20.0g稀硫酸的烧杯中倒入5.0g黄铜(铜锌合金)样品粉末,恰好完全反应。称得剩余固体质量3.7g。求:
(1)该样品中含锌的质量______g。
(2)所用稀硫酸中溶质的质量分数______(写出计算过程)
【答案】1.3g 9.8%
【解析】
(1)由金属活动性顺序表可知,铜和锌中只有锌能够和稀硫酸反应,所以剩余的3.7g不溶性物质为铜,也就可以确定锌的质量为5.0g-3.7g=1.3g,故填1.3;(2)根据样品中锌的质量,再根据化学方程式计算求出反应的硫酸的质量,即可求出硫酸溶液的质量分数,计算过程为:
解:设参加反应的稀硫酸中溶质的质量为x

解得x=1.96g,稀硫酸中溶质质量分数=![]() ×100%=9.8%
×100%=9.8%
答:(1)该黄铜样品中含Zn的质量为 1.3g,(2)所用稀硫酸中溶质的质量分数是9.8%;故填9.8%。

练习册系列答案
相关题目
【题目】初中常见的3种元素X、Y和Z的相关信息如表所示:
元素 | X | Y | Z |
相关 信息 | X的单质甲是一种清洁能源 | Y是地壳中合量最多的元素 | Z的某种单质是天然存在的最硬的物质 |
(1)单质甲的化学式是______,Z元素能组成一种能做电极的单质名称是______;
(2)A、B、C三种物质均是由只含有上述3种元素中的若干种组成的单质或化合物,G是由Ca、Y和Z三中元素组成,它们之间的转化关系如图所示(“→”表示转化关系,部分反应物、生成物及反应条件已略去):

①G的化学式是______;
②若A中不含X元素,则G→A的化学方程式是______;
③若A中不含Z元素,且A是最常见的无机溶剂,则A→C的化学方程式是______。