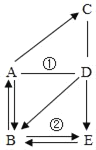
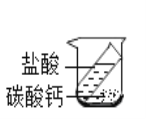
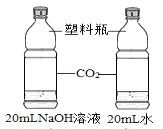
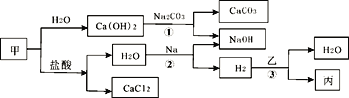
题目内容
【题目】下列图示的实验操作正确的是
A. 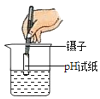 测溶液的pHB.
测溶液的pHB. 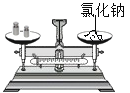 称取氯化钠
称取氯化钠
C. 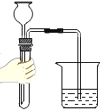 检查气密性D.
检查气密性D.  过滤悬浊液
过滤悬浊液
【答案】D
【解析】
A、用pH试纸测定未知溶液的pH时,正确的操作方法为取一片pH试纸放在玻璃片或白瓷板上,用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.不能将pH试纸伸入待测液中,以免污染待测液,图中所示操作错误。
B、托盘天平的使用要遵循“左物右码”的原则,图中所示操作砝码与药品位置放反了,图中所示操作错误。
C、该装置未构成封闭体系,即左边的长颈漏斗与大气相通;无论该装置气密性是否良好,导管口都不会有气泡产生,不能判断气密性是否良好,图中所示操作错误。
D、过滤液体时,要注意“一贴、二低、三靠”的原则,图中所示操作正确。
故选:D。

 名校课堂系列答案
名校课堂系列答案【题目】某同学按课本要求做CuSO4溶液与NaOH溶液反应的实验,有蓝色沉淀生成,对该沉淀进行加热,一般看到蓝色沉淀变黑色,可有时却看到蓝色沉淀变绿色。该同学对着异常现象产生了兴趣,决定对这现象产生的实验条件进行探究。
(查阅资料)难溶性碱受热易分解成对应的金属氧化物
写出上述生成蓝色沉淀以及蓝色沉淀变黑色的化学反应方程式:___________、__________。
(提出问题)加热蓝色沉淀没有出现黑色固体与什么因素有关?
(作出猜想)1.与CuSO4溶液过量有关;2.与NaOH溶液过量有关
(设计实验)限选试剂:1%的NaOH溶液,20%NaOH溶液,20%CuSO4溶液,1%CuSO4溶液
实验方案 | 实验现象 | 实验结论 |
1.往2mL20%CuSO4溶液中滴加2滴1%NaOH溶液,再将所得沉淀加热。 | 先产生蓝色沉淀,加热后 ______。 | 猜想1不成立 |
2._____,再将所得沉淀加热。 | 先产生蓝色沉淀,加热后 _______。 | 猜想2成立 |
(得到结论)在上述实验中,要能观察到蓝色沉淀变黑色,关键是___________
(拓展与反思)进一步查阅资料可知上述绿色物质是溶解度与氢氧化铜更小的水胆矾[化学式为Cu4(OH)6SO4],在碱性较强的条件下容易形成,继续加热一段时间该绿色固体则可产生黑色沉淀,写出该反应方程式__________.