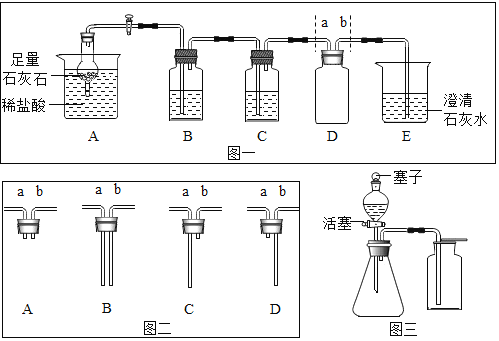
题目内容
【题目】实验室以一种工业废渣(主要成分为MgCO3、MgO和SiO2)为原料制备MgCO33H2O.其主要实验过程如图:
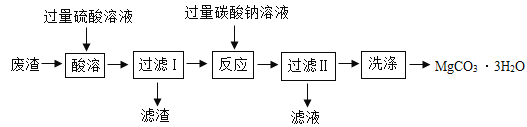
已知:SiO2不溶于水,常温下不与硫酸、碳酸钠反应。
(1)“酸溶”时发生反应的化学方程式为_____和_____。
(2)“过滤Ⅱ”所得滤液中含有的主要离子有_____(填离子符号)。
(3)“反应”步骤前后均有过滤,能否省去“过滤Ⅰ”只进行“过滤Ⅱ”。_____(填“能”或“否”),理由是_____。
(4)“酸溶”时所加硫酸溶液不宜过量太多的原因是_____。
【答案】MgO+H2SO4=MgSO4+H2O MgCO3+H2SO4=MgSO4+H2O+CO2↑ Na+、SO42﹣、CO32﹣ 否 导致产品不纯 避免制备产品消耗更多的碳酸钠
【解析】
氧化镁和硫酸反应生成硫酸镁和水,碳酸镁和硫酸反应生成硫酸镁、水和二氧化碳。
(1)“酸溶”时是氧化镁和硫酸反应生成硫酸镁和水,化学方程式为
![]() ,碳酸镁与硫酸反应生成硫酸镁、水和二氧化碳,化学方程式为
,碳酸镁与硫酸反应生成硫酸镁、水和二氧化碳,化学方程式为![]() 。
。
(2)滤液I为生成的硫酸以及生成的硫酸镁的混合溶液,和过量碳酸钠反应,生成硫酸钠以及碳酸镁,还剩余碳酸钠,所以“过滤Ⅱ”所得滤液中含有的主要离子有
![]() 。
。
(3)“反应”步骤前后均有过滤,不能省去“过滤Ⅰ”只进行“过滤Ⅱ”,会导致得到的产品因为混油二氧化硅而不纯。
(4)“酸溶”时所加硫酸溶液不宜过量太多的原因是过量的硫酸需要加入碳酸钠进行去除,所以是避免制备产品消耗更多的碳酸钠。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目