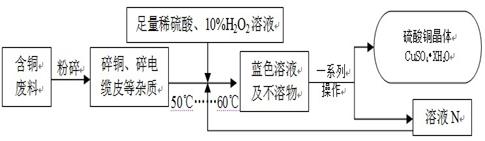
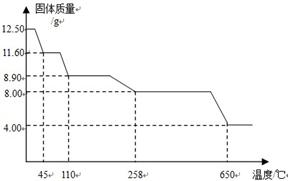
题目内容
下列有关物质鉴别方案正确的一组是:
| A.可用Ba(OH)2溶液鉴别(NH4)2CO3、(NH4)2SO4、NH4NO3三种氮肥 |
| B.MgCl2溶液、NaOH溶液、H2SO4溶液、CuSO4溶液,不加任何试剂即可鉴别 |
| C.Na2CO3溶液、Ca(OH)2溶液、盐酸、BaCl2溶液,不加任何试剂即可鉴别 |
| D.CuO粉末、炭粉、铁粉,三种黑色粉末用一种试剂无法鉴别 |
B
A中Ba(OH)2溶液与(NH4)2CO3、(NH4)2SO4、NH4NO3分别反应都有刺激性气味的气体产生,且与(NH4)2CO3、(NH4)2SO4反应都生成白色沉淀,只能鉴别出NH4NO3;蓝色溶液是硫酸铜溶液,将剩余三种无色液体滴入硫酸铜溶液,产生蓝色沉淀的是NaOH溶液,再将剩余的两种无色液体滴入蓝色沉淀,能使蓝色沉淀溶解的是H2SO4溶液,不能的是MgCl2溶液;分别取四种药品两两混合,观察现象Na2CO3溶液(↓↑↓)Ca(OH)2溶液(↓——)盐酸(↑——)BaCl2溶液(↓——),由此可见只能鉴别出碳酸钠溶液和盐酸;CuO粉末、炭粉、铁粉,三种黑色粉末用一种试剂盐酸(或稀硫酸)来鉴别,出现三种不同的现象。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
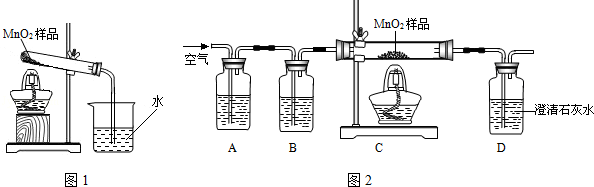

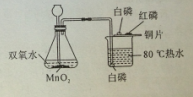

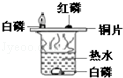
 2Na2S4+2Na2S2O3+4CO2,X 的化学式为 ,蘸有浓NaOH 溶液的棉花的作用是 。
2Na2S4+2Na2S2O3+4CO2,X 的化学式为 ,蘸有浓NaOH 溶液的棉花的作用是 。