��Ŀ����
С��ʵ�����ģ�⿼�ԵĿ����ǣ���̼������Һ����ϡ���ᡢʳ��ˮ�ͳ���ʯ��ˮ��
������ʵ�顿
���������⡿��δ���������Һ���ܼ��ٶԻ�������Ⱦ��
��˼���������Ӧ�ȶԷ�Һ�е����ʳɷֽ���̽�������ƶ�������
��ʵ����̽����
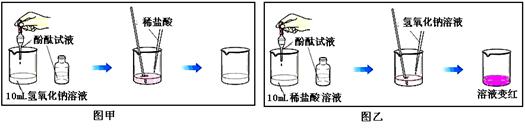
��С�������з�Һ����һ�ྻ�ձ��У����ú�õ��ϲ���Һ��
��ȡ������Һ�����������Ȼ�����Һ�����ԣ����ٵμӼ�����ɫ��̪��Һ�������� ������˵���ϲ���Һ��һ����̼���ƺ��������ƣ�һ��û�� �������ӷ��ţ���
��������Ӧ�á�ͨ������̽��������������Һ����ȷ������ �Լ��ٶԻ�������Ⱦ��
������ʵ�顿
| �������� | ʵ������ | ʵ����� |
| �ֱ���A��B��C��֧�Թ�ȡ����Ȼ�����������̼������Һ | A������������ B�� C�� | A�е�������ʳ��ˮ B�е�������ϡ���ᣬ������Ӧ�ķ���ʽ C�е������dz���ʯ��ˮ |
���������⡿��δ���������Һ���ܼ��ٶԻ�������Ⱦ��
��˼���������Ӧ�ȶԷ�Һ�е����ʳɷֽ���̽�������ƶ�������
��ʵ����̽����
��С�������з�Һ����һ�ྻ�ձ��У����ú�õ��ϲ���Һ��
��ȡ������Һ�����������Ȼ�����Һ�����ԣ����ٵμӼ�����ɫ��̪��Һ�������� ������˵���ϲ���Һ��һ����̼���ƺ��������ƣ�һ��û�� �������ӷ��ţ���
��������Ӧ�á�ͨ������̽��������������Һ����ȷ������ �Լ��ٶԻ�������Ⱦ��
������ʵ�顿B�������ݲ�������Ӧ����ʽ��Na2CO3+2HCl==2NaCl+H2O+CO2����C�в�����ɫ������
��ʵ����̽������2��������ɫ��������Һ�ʺ�ɫ�� H+�� Ca2+��
��������Ӧ�á�������Һ�������������ŷš�
��ʵ����̽������2��������ɫ��������Һ�ʺ�ɫ�� H+�� Ca2+��
��������Ӧ�á�������Һ�������������ŷš�
���������������ʵ��̽������ʽ��������ε����ʼ���Ӧ���Ѷ�ϵ���ϴ�ϡHCl��Ca(OH)2��NaCl�ֱ�������Σ����������ʵķ�Ӧ��ʮ�ֳ����ģ�����������ʵ�鲿�֣������������ĵ�̼�������ף������ѧ֪ʶ���ǿ����жϲ������ݷų�������̼����ϡHCl��������ɫ������ΪCa(OH)2������Ŀ��֪A������������A����NaCl������Ҳ��ʵ�������ʾBΪϡ���ᣬ���ԣ�ʵ������B��Ӧ��д�����ݲ�������Ӧ�ұ�B�Ļ�ѧ����ʽ��Na2CO3+2HCl==2NaCl+H2O+CO2��������C����Ca(OH)2������ʵ���������C�в�����ɫ������ʵ����̽���У����ȵμ��Ȼ��������Եģ�����û�иı���Һ��PHֵ���ٵμ���ɫ��̪�Լ�����̪��һ�����ָʾ����������ɫ�������죬��Ϻ�����ʾ����̼���ƺ��������ƣ�̼���ƿ��Ժ��Ȼ��Ʋ�����ɫ����̼��ƣ�������Ӧ����д��������ɫ��������Һ�ʺ�ɫ�������Һ����û�г��������ּ��ԣ�����һ��û�е��ǡ�H+�� Ca2+��������������Һ����ȷ������������Һ�dzʼ��ԣ������Ǽ����������Һ�����Ժ����ŷš�
��������ȷ�Ͻ����Ƶ���Һ�е������ǽ��������Ĺؼ����ڣ��������ѵIJ�����ʵ����̽����2���ĵ�2�ʣ�����Ҫ�����漰������η�Ӧ�����������Ƶ����������⡣

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
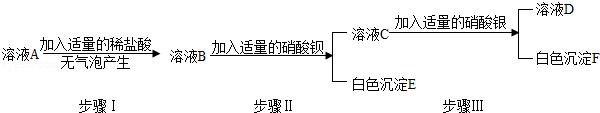
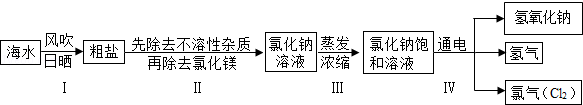
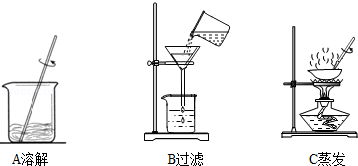
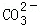
 Na2CO3��+CO2 ��+H2O ��
Na2CO3��+CO2 ��+H2O ��