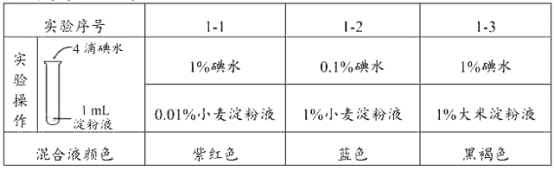
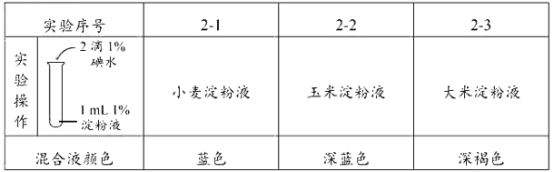
题目内容
【题目】利用海水(含氯化钠、氯化镁)处理含二氧化硫废气的方法如下:
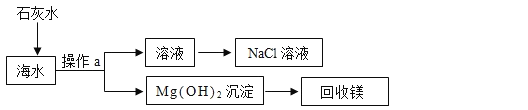
(1)NaCl溶液能导电,是因为NaCl在水分子作用下,解离出______。
(2)经操作a得到的Mg(OH)2沉淀需要洗净,为证明是否洗净,可取洗涤液少量,向其中加入下列试剂中的______(填字母序号),即可达到实验目的。
A.Na2CO3溶液 B.石灰水 C.稀盐酸 D.稀硫酸
(3)如图中从海水到得到NaCl溶液的过程属于______(填“物理变化”或“化学变化”)
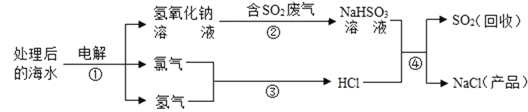
(4)图中反应①、③、④属于化合反应的是______(填序号)。
(5)①中反应的化学方程式为______。
(6)④中反应的化学方程式为______。
【答案】Na+、Cl- A 化学变化 ③ 2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑ NaHSO3+HCl═NaCl+SO2↑+H2O
2NaOH+H2↑+Cl2↑ NaHSO3+HCl═NaCl+SO2↑+H2O
【解析】
(1)NaCl溶液能导电,是因为NaCl在水分子作用下,解离出钠离子和氯离子,故填Na+、Cl- ;
(2)海水中含氯化钠、氯化镁,氯化镁与石灰水反应可生成Mg(OH)2沉淀,化学反应方程式是MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2,要检验经操作a得到的Mg(OH)2沉淀是否洗净,就要加入能与CaCl2反应产生明显现象的试剂,Na2CO3溶液可以与CaCl2反应生成白色沉淀,石灰水、稀盐酸、稀硫酸和氯化钙都不反应,无明显现象,故填A;
(3)由题意可知,从海水最终得到“NaCl(产品)”经过反应①②③④,每个反应都生成了新物质,都发生了化学变化,故填化学变化;
(4)化合反应是多种物质反应生成一种物质,③氯气和氢气反应生成氯化氢的反应属于化合反应,反应① 的方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;,不属于基本反应类型,反应④的化学方程式为NaHSO3+HCl═NaCl+SO2↑+H2O,属复分解反应,故填③;
2NaOH+H2↑+Cl2↑;,不属于基本反应类型,反应④的化学方程式为NaHSO3+HCl═NaCl+SO2↑+H2O,属复分解反应,故填③;
(5)由上分析可知①中的反应物是氯化钠和水,生成物是氢气、氯气和氢氧化钠,化学方程式故填2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(6)由上分析可知反应④是硫酸氢钠和盐酸反应生成二氧化硫、水和氯化钠的过程,化学方程式故填NaHSO3+HCl═NaCl+H2O+SO2↑。

 华东师大版一课一练系列答案
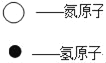
华东师大版一课一练系列答案【题目】物质丙是重要的化工产品,在国民经济中占有重要地位。工业上用甲和乙合成丙。甲、乙、丙的微观示意图见下表。请完成下列空白。
物质 | 甲 | 乙 | 丙 |
|
微观示意图 |
|
|
|
(1)甲、乙、丙3种物质都是由 (填“分子”“原子”或“离子”)_____构成的。
(2)甲、乙、丙中属于化合物的是_____。
(3)物质丙中氮元素的化合价为_____。
(4)丙中氮、氢元素的质量比为_____。
(5)写出甲和乙在高温、高压、催化剂的条件下合成丙的化学方程式:_____。
【题目】硝酸钾的部分溶解度数据见下表。
温度(℃) | 10 | 20 | 40 | 60 |
溶解度(g/100g 水) | 20.9 | 31.6 | 63.9 | 110 |
①20℃时,称取 10.0 克硝酸钾固体加入到 40 克水中,用_____(写出仪器名称)搅拌,充分溶解后得到_____(选填“饱和”或“不饱和”)溶液。
②将上述溶液升温至 60℃,所得溶液的溶质质量分数为_____。
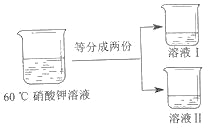
③将 60℃的硝酸钾溶液进行如图所示操作。
将溶液 I 降温,开始析出硝酸钾晶体的温度介于_____℃(选填编号之间。
A. 40-60 B. 20-40 C. 10-20 D. 低于 10
为得到 60℃时硝酸钾饱和溶液,将溶液 II 恒温蒸发 15 克水,请分析该操作能否达到实验目的并说明理由_____。