题目内容
【题目】为测定锌铜合金中锌的含量,取该合金放入如右图盛有稀硫酸的锥形瓶中 。多次实验后,取平均值所得数据如下表:
反应前 | 充分反应后装置及反应剩余物质质量 | |
装置和足量的稀硫酸质量 | 锌铜合金质量 | |
342.10g | 16.00g | 357.70g |

若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量 。
(2)该合金中锌的质量分数。
【答案】(1)0.4克(2)81.25%
【解析】
试题分析:依题意可得氢气的质量=342.10g+16.00g-357.70g =0.4g
解:设该合金中锌的质量为x。
Zn + H2SO4=ZnSO4+H2↑
65 2
x 0.4g
列比例式得:65︰2= x︰0.4g 解得: x=13 g
合金中锌的质量分数=13 g÷16 g×100%=81.25%

练习册系列答案
相关题目
【题目】有一包白色粉末,可能由CuSO4、Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种组成。为探究其组成,同学们查阅资料得知NaCl、BaCl2溶液呈中性。他们经过思考设计并进行了以下实验
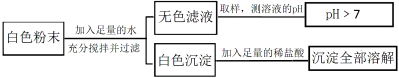
请分析实验过程,回答下列问题:
(1)白色粉末中一定不含 ,可能含有 。
(2)生成白色沉淀的化学方程式为 。
(3)为最终确定白色粉末的组成,还需要对无色滤液中呈碱性的物质进行探究。
[提出问题]无色滤液中呈碱性的物质是什么?
[做出猜想]猜想Ⅰ:Na2CO3。 猜想Ⅱ:NaOH。 猜想Ⅲ: 。
[进行实验]
实验步骤 | 实验现象 | 实验结论 |
①取无色滤液少许于试管中,滴加过量的BaCl2溶液。 | 产生白色沉淀。 | 猜想Ⅱ不成立。 |
②在①反应后的试管中滴加 。 | 溶液变为红色。 | 猜想Ⅲ成立。 |
[得出结论]白色粉末的成分是 。