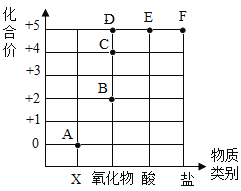
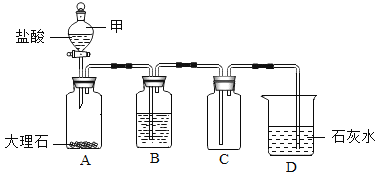
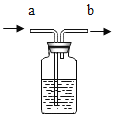
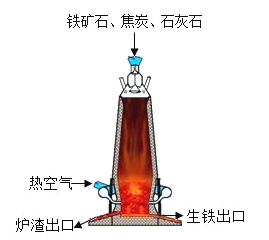
题目内容
【题目】某有机物R完全燃烧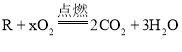 ,实验测得反应前后各物质的质量如下表:
,实验测得反应前后各物质的质量如下表:
物质 | R | 氧气 | 二氧化碳 | 水 |
反应前质量(g) | 4.6 | 9.6 | 0 | 0 |
反应后质量(g) | 0 | 0 | 8.8 | 5.4 |
请计算:
(1)8.8g二氧化碳中碳元素的质量是_____g。
(2)5.4g水中氢元素质量是0.6g,依据_____,则R中氢元素质量也是0.6g;所以R中氧元素质量是_____g。
(3)设R的化学式为CaHbO,则a:b=_____。
【答案】2.4g 质量守恒定律 1.6g 1:3
【解析】
(1)8.8g二氧化碳中含碳元素的质量![]() ;
;
(2)5.4g水中氢元素的质量为:![]() ,根据质量守恒定律,反应后的氢、碳元素全部来自于R,故R中的氢元素的质量为0.6g,碳元素的质量为2.4g,则R中的氧元素的质量为4.6g-0.6g-2.4g=1.6g;
,根据质量守恒定律,反应后的氢、碳元素全部来自于R,故R中的氢元素的质量为0.6g,碳元素的质量为2.4g,则R中的氧元素的质量为4.6g-0.6g-2.4g=1.6g;
(3)反应后的水中的氢元素和二氧化碳中碳元素全部来自于R,则R中碳元素和氢元素的质量比为2.4g:0.6g=12a:b,故则a:b=1:3。

 名校课堂系列答案
名校课堂系列答案【题目】某兴趣小组提纯含少量泥沙的粗盐,一般经过如图甲所示操作流程:
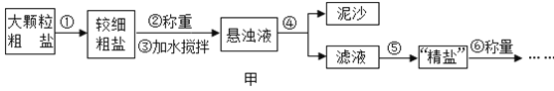
(1)操作①中玻璃棒的作用_________。
(2)溶液蒸发时溶质的质量分数随时间的变化如图乙所示下表是食盐的溶解度表:
温度(C) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
食盐(克) | 35.5 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.3 | 38.9 | 39.8 |
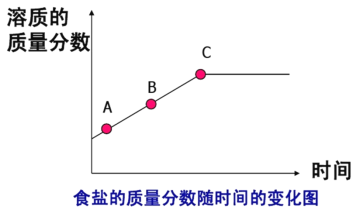
图乙
假设C时刻溶液的温度为90°C,请你查找资料计算出此时溶质的质量分数___________。
(3)实验结束后称量获得的精盐,计算发现精盐的质量明显偏小,其原因可能有_______(填数字序号)。
①溶解时,溶解不够充分②过滤时,滤渣没有清洗③蒸发时,液滴飞残
④蒸发后所得的食盐很潮湿⑤转移后,蒸发皿上还沾有食盐
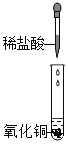
【题目】学习盐酸的化学性质后,小娟做如下实验:
(实验探究)
实验步骤 | 实验操作 | 实验现象 | 结论或解释 |
Ⅰ |
| 黑色固体完全溶解,溶液呈_____色 | 盐酸与氧化铜发生了化学反应 |
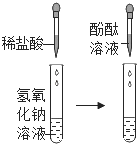
Ⅱ |
| 加入稀盐酸后,未观察到明显现象;滴入酚酞后,溶液变红色 | 盐酸与氢氧化钠未发生化学反应 |
Ⅲ |
将步骤Ⅰ、Ⅱ的废液混合 | 有沉淀生成,溶液仍为红色 | 生成沉淀的原因(用化学方程式解释)_____;所得溶液中溶质的成分_____(酚酞除外) |
(实验反思)
小勇认为小娟实验步骤Ⅱ的结论不正确,理由是_____,于是小娟另取试管重新做了步骤Ⅱ的实验,在滴入酚酞溶液变红色后,继续滴加稀盐酸。边滴边振荡。当观察到_____时,说明盐酸与氢氧化钠发生了反应。从微观角度看,此反应的实质是_____。
实验结束后,小娟将步骤Ⅲ烧杯中的溶液进行了过滤,并向所得溶液中加入_____再倒掉,以防止环境污染。
【题目】25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是
编号 | ① | ② | ③ | ④ |
水的质量/g | 50 | 50 | 50 | 50 |
加入固体质量/g | 5 | 10 | 15 | 20 |
现象 | 固体完全溶解 | 固体完全溶解 | 剩余少量固体 | 剩余较多固体 |
A. 实验①所得溶液质量分数为10%
B. 实验说明25℃时该物质的溶解度是20g
C. 实验③④所得溶液质量分数相同
D. 实验④所得溶液中含溶质20g