��Ŀ����
����Ŀ��ѧϰ����Ļ�ѧ���ʺ�С��������ʵ�飺
��ʵ��̽����
ʵ�鲽�� | ʵ����� | ʵ������ | ���ۻ���� |
�� |
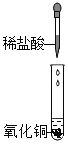
| ��ɫ������ȫ�ܽ⣬��Һ��_____ɫ | ����������ͭ�����˻�ѧ��Ӧ |
�� |
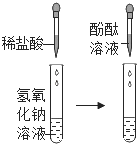
| ����ϡ�����δ�۲쵽�����������̪����Һ���ɫ | ��������������δ������ѧ��Ӧ |
�� |
�������ķ�Һ��� | �г������ɣ���Һ��Ϊ��ɫ | ���ɳ�����ԭ���û�ѧ����ʽ���ͣ�_____��������Һ�����ʵijɷ�_____����̪���⣩ |
��ʵ�鷴˼��
С����ΪС��ʵ�鲽���Ľ��۲���ȷ��������_____������С����ȡ�Թ��������˲�����ʵ�飬�ڵ����̪��Һ���ɫ�����μ�ϡ���ᡣ�ߵα������۲쵽_____ʱ��˵���������������Ʒ����˷�Ӧ�����۽Ƕȿ����˷�Ӧ��ʵ����_____��
ʵ�������С�꽫������ձ��е���Һ�����˹��ˣ�����������Һ�м���_____�ٵ������Է�ֹ������Ⱦ��
���𰸡���CuCl2+2NaOH�TCu��OH��2��+2NaClNaCl��NaOH�������ƹ�����Һ��ɫǡ����ȥ�����Ӻ����������ӷ�Ӧ������ˮ��������
��������
��������ͭ�еμ�ϡ���ᣬ�������Ȼ�ͭ��ˮ��������Ӧ�Ļ�ѧ����ʽΪ��CuO+2HCl�TCuCl2+H2O����ɫ������ȫ�ܽ⣬������ɫ���Ȼ�ͭ��Һ�������������ķ�Һ����г������ɣ���Һ��Ϊ��ɫ��˵������������ɵ��Ȼ�ͭ�벽�����ʣ����������Ʒ�Ӧ����������ɫ��������ͭ������������Ӧ�Ļ�ѧ����ʽΪ��CuCl2+2NaOH�TCu��OH��2��+2NaCl���ɷ�Ӧ����Һ�Գʺ�ɫ֪������������Һ��ʣ�࣬��˷�Ӧ��������Һ�е�����ΪNaCl��NaOH����ʵ�鷴˼����������������һ����������кͷ�Ӧ��ʵ�鲽����еμ���ɫ��̪���죬����Ϊ�������ƹ�����Ϊʹ�������������Ʒ�Ӧ����������ԣ���������������Һ���ȵ�����ɫ��̪����ʱ��̪��죬Ȼ��ߵμ�ϡ�������ֱ����Һ��ɫǡ����ȥ��˵���������������Ʒ����˷�Ӧ�����۽Ƕȿ����кͷ�Ӧǰ��������Ӻ�������Ӿ�Ϊ�����ı䣬����кͷ�Ӧ��ʵ�ʶ��������Ӻ����������ӷ�Ӧ������ˮ���ӣ�����������֪���������ձ��к����������ƣ�Ϊ��С��Ի�������Ⱦ��Ӧ��������ߴ��Ὣ���кͺ��ٵ�����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�