题目内容
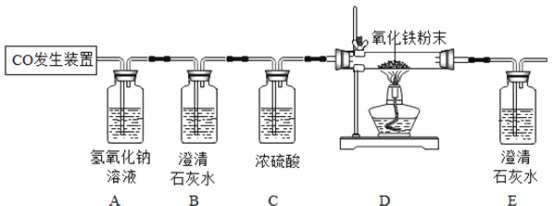
【题目】化学兴趣小组同学利用下图装置制备干燥的二氧化碳气体并探究其性质,实验时发现,D烧杯中饱和石灰水先变浑浊,后逐渐澄清。
(1)组装好实验装置,加药品前应先进行的操作是____________,装置B中盛装的试剂是_____________。
(2)为探究“饱和石灰水浑浊后变澄清的原因”,该小组同学开展了如下活动:
[查阅文献]碳酸盐与二氧化碳、水反应生成可溶于水的碳酸氢盐; HCl可以与NaOH、Ca(OH)2反应生成对应氯化物和水;也可以与NaHCO3反应生成二氧化碳等。
[提出假设]①假设l:挥发出的HCl使浑浊变澄清,反应的化学方程式是____________。
②假设2:碳酸钙与二氧化碳、水反应生成可溶于水的碳酸氢钙,从而浑浊变澄清,该反应的化学方程式是____________。
③[设计实验]为除去CO2中的HCl,小组同学在上图中增加下图装置,装置中盛装的试剂是__________(填选项序号)。
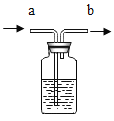
A浓硫酸
B NaOH溶液
C饱和Na2CO3溶液
D饱和NaHCO3溶液
[实验现象]饱和石灰水浑浊后继续通入足量CO2,沉淀部分溶解但最终并未完全澄清。
④[得出结论]由以上探究可得出结论____________。
(3)该兴趣小组在老师指导下,分析得知图D烧杯中随反应的进行二氧化碳和挥发出的HCl同时反应,其反应的化学方程式分别为____________,____________。
【答案】检查装置气密性 浓硫酸 CaCO3+2HCl=CaCl2+H2O+CO2↑ CO2+ CaCO3+H2O=Ca(HCO3)2 D 二氧化碳只能使饱和石灰水生成的沉淀部分溶解,挥发出的氯化氢气体能使饱和的石灰水生成的沉淀溶解变澄清 CO2+Ca(OH)2=CaCO3![]() +H2O Ca(OH)2+2HCl=CaCl2+2H2O
+H2O Ca(OH)2+2HCl=CaCl2+2H2O
【解析】
(1)组装好实验装置,加药品前应先进行的操作是检查装置气密性;装置B中盛装的试剂是浓硫酸,浓硫酸具有吸水性,可以干燥生成的二氧化碳气体;
(2)提出假设:
假设1:挥发出的HCl使浑油变澄清,是由于氯化氢气体溶于水生成的稀盐酸能与碳酸钙反应生成了氯化钙、二氧化碳和水,反应的化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;
假设2:碳酸钙与二氧化碳、水反应生成可洛于水的碳酸氢钙,化方程式为:CO2+ CaCO3+H2O=Ca(HCO3)2;
设计实验:
由于二氧化碳不溶于碳酸氢钠溶液,氯化氢气体能与碳酸氢钠反应生成二氧化碳气体,所以小组同学在图1中增加图2装置,装置2中盛装的试剂是碳酸氢钠溶液,能除去杂质且没有引入新的杂质,符合除杂原则。故选D;
得出结论:
饱和石灰水浑浊后,继续通入足量CO2,沉淀部分溶解但最终并未完全澄清,而挥发出来的氯化氢使饱和石灰水产生的浑浊最终变澄清;由此可得出的结论是:二氧化碳只能使饱和石灰水生成的沉淀部分溶解,挥发出的氯化氢气体能使饱和的石灰水生成的沉淀溶解变澄清。
(3)由图示可知,由于二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,氯化氢与氢氧化钙反应生成氯化钙和水,化学方程式为:CO2+Ca(OH)2=CaCO3![]() +H2O,Ca(OH)2+2HCl=CaCl2+2H2O。
+H2O,Ca(OH)2+2HCl=CaCl2+2H2O。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】某有机物R完全燃烧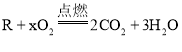 ,实验测得反应前后各物质的质量如下表:
,实验测得反应前后各物质的质量如下表:
物质 | R | 氧气 | 二氧化碳 | 水 |
反应前质量(g) | 4.6 | 9.6 | 0 | 0 |
反应后质量(g) | 0 | 0 | 8.8 | 5.4 |
请计算:
(1)8.8g二氧化碳中碳元素的质量是_____g。
(2)5.4g水中氢元素质量是0.6g,依据_____,则R中氢元素质量也是0.6g;所以R中氧元素质量是_____g。
(3)设R的化学式为CaHbO,则a:b=_____。