题目内容
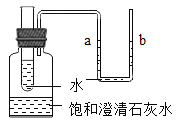
【题目】城市居民生活所需净水,主要靠自来水厂供给。某化学兴趣小组的同学决定模拟自来水厂的净水过程,将河水(主要含有泥沙、悬浮物和细菌等杂质)最终制成蒸馏水。其净水流程如图所示,请回答下列问题:

(1)加入明矾的目的是___________。
(2)操作I的名称是____________。
(3)我国生活饮用水的标准:
感官指标 | 化学指标 | 细菌学指标 |
水质无色无味且澄清透明 | 总硬度 < 250 mg/L(以碳酸钙计);铜<1.0 mg/L..等 | 细菌总数<100个/mL等 |
自来水厂净水流程图中一定达到“细菌学指标”的液体是________(填序号)。
①液体B
②液体C
③液体D
(4)蒸馏水是_____________(填“硬水”或“软水”)。
(5)操作II的名称是________________。
【答案】产生胶状物,吸附杂质,使杂质沉降 过滤 ③ 软水 蒸馏
【解析】
自来水厂净化过程:取水—加絮凝剂—沉淀—过滤—吸附—消毒—配送。絮凝剂:一般采用明矾,吸附水中悬浮的杂质;沉淀池:沉降大颗粒杂质;过滤池:除去不溶性杂质;活性炭:吸附作用,吸附颜色和异味;投药消毒:杀死细菌。我们可以根据流程解答相应问题。
(1)加入明矾的作用是产生胶状物,吸附杂质,使杂质沉降。
(2)为除去水中固体沉积物和一些难溶杂质,进行了实验操作操作I,因此操作I应该是过滤。
(3)图中一定达到“细菌学指标”的液体应该是加入氯气杀菌消毒后的液体,因此应为液体 D,故选③。
(4)水中含有较高的钙镁离子时为硬水,硬水经过蒸馏,会去除水中的离子,包括钙镁离子,所以,蒸馏水是软水。
(5)使液体D变为蒸馏水的操作应当是蒸馏。

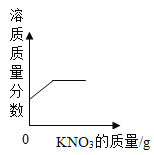
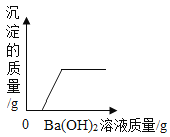
【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
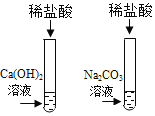
将反应后两只试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行探究。
[提出问题]滤液中溶质的成分是什么?
[假设与猜想]猜想一: NaCl
猜想二: NaCl 和CaCl2
猜想三: NaCl、Ca(OH)2 和HCl
猜想四:___________。
[讨论与交流]经讨论同学们一致认为猜想_________是错误的。原因是____________(用化学方程式解释)
[实验与结论]
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量碳酸钠溶液 | 无现象 | 猜想四成立 |
取少量滤液于试管中,滴加适量_______________ | ______________________ |
[拓展与迁移]稀盐酸和稀硫酸有相似的化学性质,是因为它们的溶液中都存在_______________。