题目内容
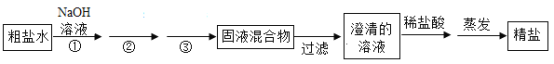
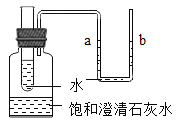
【题目】(1)如图所示,广口瓶中盛有少量饱和澄清石灰水,小试管和U形管中均有适量水,现向小试管中加入适量某物质。如果观察到U形管中a液面下降,b液面上升,则加入的物质可能是___或____等;饱和澄清石灰水出现的变化是________,原因是_______。
(2)配制溶质质量分数为10%的某溶液。经检测,所配制溶液的溶质质量分数偏小,其原因可能是_____(填序号)。
①氯化钠固体不纯 ②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
【答案】NaOH固体 浓硫酸(或CaO) 石灰水变浑浊 氢氧化钠固体(或浓硫酸)溶于水放出大量的热(氧化钙与水反应放出大量的热),使溶液温度升高;氢氧化钙的溶解度随着温度的升高而减小,有氢氧化钙析出,则饱和澄清石灰水变浑浊 ①②③
【解析】
(1)U形管中a液面下降,b液面上升,说明广口瓶内的压强增大,则试管内加入的物质溶于水或与水反应放热,导致温度升高,则加入的物质可能是NaOH固体或浓硫酸(或CaO,氧化钙是与水反应放热);饱和澄清石灰水出现的变化是变浑浊,原因是氢氧化钠固体或浓硫酸是溶于水放出大量的热(氧化钙是与水反应放出大量的热),使溶液温度升高;氢氧化钙的溶解度随着温度的升高而减小,有氢氧化钙析出,则饱和澄清石灰水变浑浊;
(2)①氯化钠固体不纯,则氯化钠减少,溶质质量分数偏小,符合题意;
②称量时,砝码端忘垫质量相同的纸片,则砝码的质量等于氯化钠加纸片,则氯化钠减少,溶质质量分数偏小,符合题意;
③量取水时,仰视读数,水的质量偏大,则溶质质量分数偏小,符合题意;
④装瓶时,溶液已经配好,溶液有均一性,有少量溶液洒出,溶质和溶剂按比例减少,对溶质质量分数没有影响,不符合题意。故选①②③。

【题目】城市居民生活所需净水,主要靠自来水厂供给。某化学兴趣小组的同学决定模拟自来水厂的净水过程,将河水(主要含有泥沙、悬浮物和细菌等杂质)最终制成蒸馏水。其净水流程如图所示,请回答下列问题:

(1)加入明矾的目的是___________。
(2)操作I的名称是____________。
(3)我国生活饮用水的标准:
感官指标 | 化学指标 | 细菌学指标 |
水质无色无味且澄清透明 | 总硬度 < 250 mg/L(以碳酸钙计);铜<1.0 mg/L..等 | 细菌总数<100个/mL等 |
自来水厂净水流程图中一定达到“细菌学指标”的液体是________(填序号)。
①液体B
②液体C
③液体D
(4)蒸馏水是_____________(填“硬水”或“软水”)。
(5)操作II的名称是________________。
【题目】下表为甲、乙、丙三种物质的溶解度。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | |
溶解度/g | 甲 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 |
乙 | 29.4 | 33.3 | 37.2 | 41.1 | 45.8 | 50.4 | |
丙 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | |
(1)三种物质中,溶解度的变化受温度影响最小的是____。
(2)使接近饱和的乙溶液变为饱和溶液的一种方法是___。
(3)20℃时,丙饱和溶液中溶质与溶液的质量比是_____。
(4)50℃时,使甲从其饱和溶液中结晶的方法是__。