题目内容
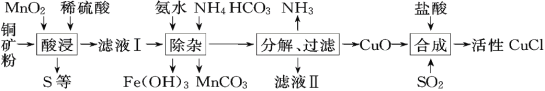
【题目】CuCl常用作有机合成催化剂,实验室以初级铜矿粉(主要成分为硫化亚铜(Cu2S)及少量Fe2O3等)为原料制备活性CuCl。实验过程如下:
(资料)
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②Cu(OH)2可溶于氨水形成深蓝色硫酸四氨合铜[Cu(NH3)4SO4]溶液;
③[Cu(NH3)4SO4]常温稳定,在热水中会分解生成NH3;
④CuCl在空气中易被氧化。
(1)酸浸时,为了提高浸取率可采取的措施有______(任写一点); “酸浸”过程中发生的化学反应有:①Cu2S+2MnO2+4H2SO4=2______+2MnSO4+S+4H2O、②______。从后续生产的角度分析,酸浸时稀硫酸不宜过量太多的原因是______。
(2)除杂过程中加足量氨水的作用①使Fe3+沉淀;②中和过量的硫酸;③______。
(3)①“分解”实验条件及现象如下表所示。
温度/℃ | 压强/kPa | 时间/min | 残液颜色 | |
A | 110 | 101.3 | 60 | 浅蓝色 |
B | 100 | 74.6 | 40 | 很浅 |
C | 90 | 60.0 | 30 | 无色透明 |
则“分解”实验条件应选______(填字母)。
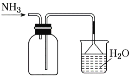
②“分解”生成的NH3可以回收利用。在实验室用如图装置来收集NH3,当集气瓶收集满NH3时观察到的现象是______。
(4)请补充从“合成”所得混合物中得到CuCl的实验操作步骤:过滤、洗涤、______。
A 真空干燥 B 在氩气中干燥 C 在空气中烘干
(5)若要制得99.5g CuCl,理论上至少需要硫化亚铜含量为60%的铜矿粉多少克______?(请写出计算过程,结果保留到小数点后一位)
【答案】矿石粉碎或者适当升高温度或者搅拌 CuSO4 Fe2O3+3H2SO4═Fe2(SO4)3+3H2O 避免除杂步骤中消耗更多的氨水和碳酸氢铵 使铜离子转化为硫酸四氨合铜[Cu(NH3)4SO4]溶液 C 漏斗中的液面忽上忽下 AB 133.3g
【解析】
(1)酸浸时,由于是固体和液体反应,为了提高浸取率,也就是反应更彻底,可以采取增大反应物接触面积的方法比如矿石粉碎或者搅拌,同时由于温度高一些反应更快更彻底,所以可以适当提高反应温度,在实际操作中可以同时实施。所以可采取的措施有矿石粉碎或者适当升高温度或者搅拌;①根据化学方程式Cu2S+2MnO2+4H2SO4=2______+2MnSO4+S+4H2O可知,反应前铜原子数为2,硫原子数为5,锰原子数为2,氧原子数为20,氢原子数为8,反应后硫原子数为3,锰原子数为2,氧原子数为12,根据质量守恒定律,在化学反应是原子的数目和种类不变,空格处应为CuSO4;②铜矿粉中含有氧化铁,氧化铁与硫酸反应生成硫酸铁和水,反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;从后续生产的角度分析,酸浸时稀硫酸不宜过量太多的原因是避免除杂步骤中消耗更多的氨水和碳酸氢铵;
(2)根据流程图可知,除杂过程中加足量氨水的作用①使Fe3+沉淀;②中和过量的硫酸;③使铜离子转化为硫酸四氨合铜[Cu(NH3)4SO4]溶液;
(3)①根据分解条件及现象的表格可知,当溶液呈无色透明时,分解最完全,且用时最少,则“分解”实验条件应选C;
②在实验室用来收集NH3,集气瓶收集满氨时,氨气极易溶于水,使漏斗中气压减小,液面上升,上升后,漏斗与烧杯中液体分离,液面又下降,现象是漏斗中的液面忽上忽下;
(4)CuCl在空气中易被氧化,从“合成”所得混合物中得到CuCl的实验操作步骤:过滤、洗涤、真空干燥或在氩气中干燥。故选AB;
(5)根据流程图可知,硫化亚铜转化为氯化亚铜过程中,铜元素的没有转化为其他物质,根据质量守恒定律可知,硫化亚铜中铜元素质量等于氯化亚铜中的铜元素质量。
设:若要制得99.5g CuCl,理论上至少需要硫化亚铜含量为60%的铜矿粉质量为x。
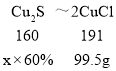
![]() x=133.3g。
x=133.3g。
答:若要制得99.5g CuCl,理论上至少需要硫化亚铜含量为60%的铜矿粉质量133.3g。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案