题目内容
【题目】海水的综合利用主要流程如下图。
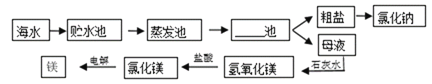
(1)上述工业生产流程图中横线上应该填写______。
(2)根据海水晒盐的工业流程,下列说法中正确的是_____(填字母)
a海水进入贮水池,海水的成分基本不变
b在蒸发池中,海水中氯化钠的质量逐渐增加
c粗盐提纯制成精盐需要用到过滤操作
d母液是氯化钠的饱和溶液
(3)制取金属镁,需要在高温熔化状态下电解氯化镁,写出该反应化学方程式___,该反应需要在氩气或者密闭的环境中进行,理由是___。
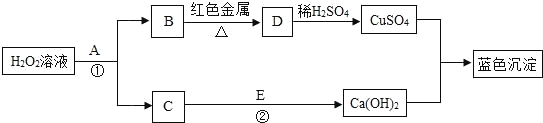
(4)如图,A——H是初中化学常见的物质。根据图示回答下列问题。
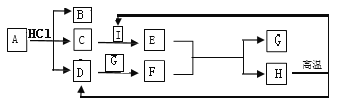
①A物质是焙制糕点的发酵粉主要成分之一,请写出B物质的一种用途____。
②H是常用的建筑材料之一,请写出D与G反应的化学方程式____。
③C与I反应的现象是____。
④该流程没有涉及到的化学基本反应类型是___。
【答案】结晶 acd MgCl2![]() Mg+Cl2↑ 高温情况下,镁要与氧气反应,氩气化学性质稳定起保护作用 调味剂、融雪剂、选种(合理即可) CO2+2NaOH=Na2CO3+H2O 放出热量 置换反应
Mg+Cl2↑ 高温情况下,镁要与氧气反应,氩气化学性质稳定起保护作用 调味剂、融雪剂、选种(合理即可) CO2+2NaOH=Na2CO3+H2O 放出热量 置换反应
【解析】
(1)海水蒸发后要经过结晶池。
(2)
a.海水进入贮水池,海水的成分基本不变,正确;
b.在蒸发池中,水分逐渐被蒸发,海水中氯化钠的质量没有改变,溶质的质量分数逐渐增加,故错误;
c.粗盐提纯制成精盐的过程中,结晶池需要用到过滤操作,故正确;
d.结晶池中获得的母液是氯化钠的饱和溶液,正确。故选acd。
(3)氯化镁在高温下电解生成镁和氯气,反应的方程式为:MgCl2![]() Mg+Cl2↑。镁是一种活泼的金属,在高温下易于氧气反应生成氧化镁,故该实验需要在氩气的环境下进行,氩气起到保护作用,防止金属镁被氧化。
Mg+Cl2↑。镁是一种活泼的金属,在高温下易于氧气反应生成氧化镁,故该实验需要在氩气的环境下进行,氩气起到保护作用,防止金属镁被氧化。
(4)A物质是焙制糕点的发酵粉主要成分之一,故A是碳酸氢钠,碳酸氢钠与稀盐酸反应生成氯化钠、二氧化碳和水,H是建筑材料,且在高温的条件下能生成I和D,故H是碳酸钙,D是二氧化碳,I是氧化钙;生成的B和C 是氯化钠或水,C能与I反应生成E,则C是水,B是氯化钠,E是氢氧化钙,氢氧化钙能与F反应生成碳酸钙和G,则F可能是碳酸钠,G可能是氢氧化钠。经分析,推断合理。
①B是氯化钠,可以做调味品。②D是二氧化碳,G是氢氧化钠,反应的方程式为:CO2+2NaOH=Na2CO3 +H2O.③C是水,I是氧化钙,水和氧化钙反应放出大量的热量。④该流程没有涉及到的化学基本反应类型是置换反应。

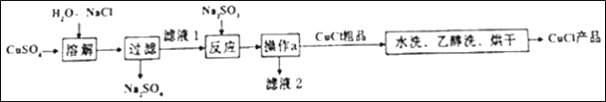
【题目】CuCl常用作有机合成催化剂,实验室以初级铜矿粉(主要成分为硫化亚铜(Cu2S)及少量Fe2O3等)为原料制备活性CuCl。实验过程如下:
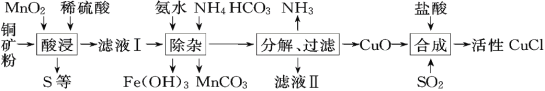
(资料)
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②Cu(OH)2可溶于氨水形成深蓝色硫酸四氨合铜[Cu(NH3)4SO4]溶液;
③[Cu(NH3)4SO4]常温稳定,在热水中会分解生成NH3;
④CuCl在空气中易被氧化。
(1)酸浸时,为了提高浸取率可采取的措施有______(任写一点); “酸浸”过程中发生的化学反应有:①Cu2S+2MnO2+4H2SO4=2______+2MnSO4+S+4H2O、②______。从后续生产的角度分析,酸浸时稀硫酸不宜过量太多的原因是______。
(2)除杂过程中加足量氨水的作用①使Fe3+沉淀;②中和过量的硫酸;③______。
(3)①“分解”实验条件及现象如下表所示。
温度/℃ | 压强/kPa | 时间/min | 残液颜色 | |
A | 110 | 101.3 | 60 | 浅蓝色 |
B | 100 | 74.6 | 40 | 很浅 |
C | 90 | 60.0 | 30 | 无色透明 |
则“分解”实验条件应选______(填字母)。
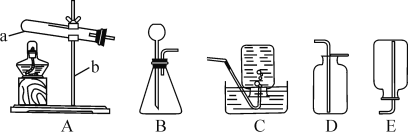
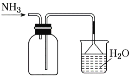
②“分解”生成的NH3可以回收利用。在实验室用如图装置来收集NH3,当集气瓶收集满NH3时观察到的现象是______。
(4)请补充从“合成”所得混合物中得到CuCl的实验操作步骤:过滤、洗涤、______。
A 真空干燥 B 在氩气中干燥 C 在空气中烘干
(5)若要制得99.5g CuCl,理论上至少需要硫化亚铜含量为60%的铜矿粉多少克______?(请写出计算过程,结果保留到小数点后一位)