题目内容
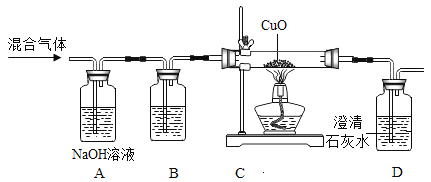
【题目】见图,在已调平的托盘天平两边各放一个等质量的烧杯,向烧杯中各加入一定量的等质量、等浓度的稀硫酸,然后在左盘的烧杯A中放入一定质量的Zn片,同时在右盘的烧杯B中放入与Zn片等质量的Fe片。

(1)反应后烧杯B中的溶液变____色。
(2)若锌和93.7g稀硫酸恰好完全反应生成0.2g氢气,则反应后所得溶液的溶质质量分数为_____?(请写出运算过程)
(3)在上述实验中,研判托盘天平指针的最终偏向和药品的剩余情况可用下面的方式 来讨论进行:把反应物的质量处理成粒子数,再通过讨论硫酸分子的数目范围,最 终确定哪种反应情况,具体见下图:

①上图中甲物质是___(填“Zn”或“Fe”)
②当硫酸分子个数为a时,反应结束后,天平指针最终指在分度盘的______填“左边”或“右边”或“正中央”),A、B两杯中反应剩余物质分别是___;
③当硫酸分子个数≥d 时,请描述在整个实验过程中指针的变化情况:____。
【答案】浅绿色 16.1% Zn 正中央 A杯中剩余的是锌,B杯中剩余的是铁 先偏向右后偏向左
【解析】
(1)铁与稀硫酸反应生成硫酸亚铁,硫酸亚铁溶液显浅绿色。
(2)设生成0.2g的氢气需要锌的质量为x,生成硫酸锌的质量为y
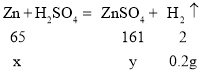
![]() =
=![]() 得x=6.5g,y=16.1g
得x=6.5g,y=16.1g
反应后所得溶液中溶质的质量分数为![]() ×100%=16.1%
×100%=16.1%
(3)①由于锌的相对原子质量大于铁的相对原子质量,故相同质量的锌和铁中铁粒子的个数较多,故甲是锌,乙是铁。
②当硫酸的质量为a时,铁和锌将硫酸完全反应,故生成的氢气的质量相等,故指针在正中央。由于硫酸完全反应,故A杯中剩余的是锌,B杯中剩余的是铁。、
③当硫酸的质量大于等于d时,由于锌的活动性比铁的强,故锌的反应速率更快,故天平向右偏转,等质量的锌和铁加入到过滤的稀硫酸中,最终生成氢气的质量铁比锌多,故指针又偏向左,所以整个实验过程中指针的变化情况是先偏向右后偏向左。

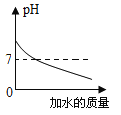
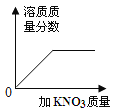
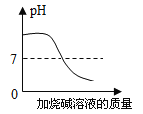
【题目】下列图像表述的化学事实与实际相符的是
A | B | C | D | |
图象 |
|
|
|
|
实验或事实 | 向pH=12的Ca(OH)2溶液中不断加水稀释 | 20C时,向一杯不饱和的KNO3溶液中逐步加入KNO3晶体 | 向稀盐酸中滴加过量的烧碱溶液 | 将一定质量的MnO2和KClO混合加热 |
A. AB. BC. CD. D
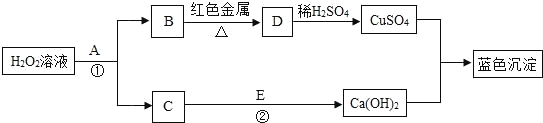
【题目】CuCl常用作有机合成催化剂,实验室以初级铜矿粉(主要成分为硫化亚铜(Cu2S)及少量Fe2O3等)为原料制备活性CuCl。实验过程如下:
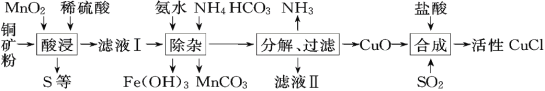
(资料)
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②Cu(OH)2可溶于氨水形成深蓝色硫酸四氨合铜[Cu(NH3)4SO4]溶液;
③[Cu(NH3)4SO4]常温稳定,在热水中会分解生成NH3;
④CuCl在空气中易被氧化。
(1)酸浸时,为了提高浸取率可采取的措施有______(任写一点); “酸浸”过程中发生的化学反应有:①Cu2S+2MnO2+4H2SO4=2______+2MnSO4+S+4H2O、②______。从后续生产的角度分析,酸浸时稀硫酸不宜过量太多的原因是______。
(2)除杂过程中加足量氨水的作用①使Fe3+沉淀;②中和过量的硫酸;③______。
(3)①“分解”实验条件及现象如下表所示。
温度/℃ | 压强/kPa | 时间/min | 残液颜色 | |
A | 110 | 101.3 | 60 | 浅蓝色 |
B | 100 | 74.6 | 40 | 很浅 |
C | 90 | 60.0 | 30 | 无色透明 |
则“分解”实验条件应选______(填字母)。
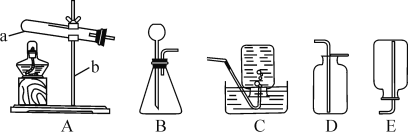
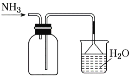
②“分解”生成的NH3可以回收利用。在实验室用如图装置来收集NH3,当集气瓶收集满NH3时观察到的现象是______。
(4)请补充从“合成”所得混合物中得到CuCl的实验操作步骤:过滤、洗涤、______。
A 真空干燥 B 在氩气中干燥 C 在空气中烘干
(5)若要制得99.5g CuCl,理论上至少需要硫化亚铜含量为60%的铜矿粉多少克______?(请写出计算过程,结果保留到小数点后一位)