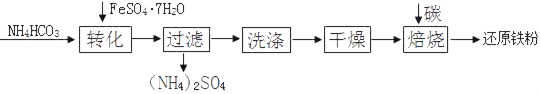
题目内容
【题目】氮气是一种重要的工业原料,广泛应用于化肥等工业。工业常用PSA变压吸附制氮气,某学习小组查阅到相关制氮气工艺流程,并展开学习,请回答相关问题:
(资料):
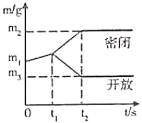
(1)、碳分子筛对不同气体的吸附强度不同,如图所示;
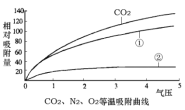
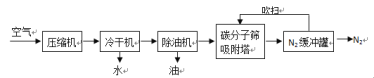
(2)、气压越大,碳分子筛吸附能力越强,反之越弱;
(3)、碳分子筛可以再生,能重复使用。
①请由高到低依次写出地壳中含量(质量分数)排在前五位的元素符号_______
②根据工艺流程,资料1图像中气体①是_______
③碳分子筛再生的方法是_______
④N2和H2在500℃、200MPa及催化剂的条件下发生反应,生成NH3,反应的化学方程式为_________,氨气中氮元素的化合价是________
【答案】O Si Al Fe Ca O2 降低吸附塔中压强(气压),利用N2吹扫,使被吸附气体和碳分子筛分离;(必须写出关键词“降低压强”) N2 + 3H2![]() 2NH3 -3价
2NH3 -3价
【解析】
①地壳中含量排在前五位的元素O 、Si 、Al、Fe、Ca;
②等体积气体相对分子质量越大,压强越大,气压越大,碳分子筛吸附能力越强,由图示可知①的吸附能力居中,所以气体的相对分子质量二氧化碳>氧气>氮气,所以资料1图像中气体①是氧气;
③降低吸附塔中压强(气压),利用N2吹扫,使被吸附气体和碳分子筛分离,所以碳分子筛可以重复使用;
④反应物是氮气和氢气,生成物是氨气,用观察法配平,反应的化学方程式为N2 + 3H2![]() 2NH3;
2NH3;
⑤氢元素显+1价,设氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(+1)×3=0,则x=-3价。

【题目】在一密闭容器中,物质X不完全燃烧时可以产生一氧化碳、二氧化碳和水。依据下表数据分析得出的结论中,正确的是
物质 | X | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量/g | 6.6 | 8.8 | 0 | 0 | 0 |
反应后质量/g | 2 | 0 | 6.6 | 5.4 | a |
A. X中碳元素的质量分数为52.2% B. X中只含有C、H两种元素
C. 表中a的值为3.4 D. 无法确定X中是否含有氧元素
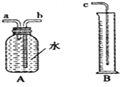
【题目】小敏研究影响锌与盐酸反应快慢的因素。
序号 | 盐酸溶液浓度 | 2分钟内产生氢气的体积 |
1 | 5% | 10mL |
2 | 15% | 28mL |
(1)写出该反应的化学方程式。
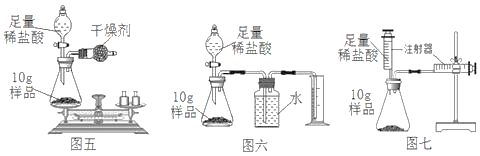
(2)图中A、B仪器可以组装一套测量气体体积的装置,利用该装置时A中的_____(a或b)管接c。
(3)他选用2克完全相同的锌片分别和同体积5%、15%的稀盐酸进行实验。获得表格数据。由此推断实验是通过_________来体现反应快慢的。
(4)小敏分析数据得到如下结论:锌与盐酸反应快慢与盐酸浓度有关,盐酸浓度越大反应越快。其他同学认为结论不可靠,他们的依据是:______________。
(5)实验中小敏发现锌与盐酸反应时,一开始产生氢气速度并没有随盐酸浓度的减少而减慢,查阅资料得知化学反应中往往伴随着能量变化。由此作出猜想:锌与盐酸反应快慢还与_______有关。