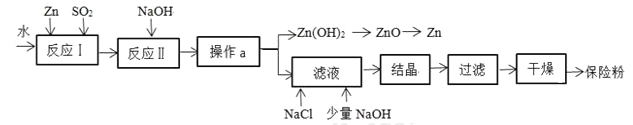
题目内容
【题目】(1)某同学用市售浓盐酸 (溶质质量分数为37%,密度为1.18gmL-1)配制100g溶质质量分数为10%的稀盐酸。通过计算可知需要浓盐酸_____mL,水 (密度为1gmL-1)_____mL。 (上述两空答案都精确到0.1mL)
(2)某混合物中含有碳酸钙和氯化钙,取该混合物12g,向其中加入一定质量的质量分数为10%的稀盐酸,恰好完全反应,产生4.4g气体。 (假设气体全部逸出)计算:
①所取混合物中碳酸钙的质量_____。
②所加稀盐酸的质量_____。
③反应后所得溶液的溶质质量分数________。 (计算结果精确到0.1%)
【答案】22.9 78.0 10g 73g 16.3%
【解析】
(1)根据溶质的质量分数以及溶液稀释过程中溶质的质量不变进行求算;
(2)根据生成的二氧化碳的质量和对应的化学方程式求算碳酸钙和盐酸溶液的质量以及生成的氯化钙的质量,进而求算对应的质量分数。
解:(1)用市售浓盐酸(溶质质量分数为37%,密度为1.18gmL-1)配制100g溶质质量分数为10%的稀盐酸;所需要的浓盐酸的质量为100g×10%÷37%≈22.0g,折合体积为22.0g÷1.18gmL-1≈22.9mL,需要的水的质量为100g-22.0g=78.0g折合体积为78.0mL;
(2)设所取混合物中碳酸钙的质量为x,所加稀盐酸的质量y,生成的氯化钙的质量为z,
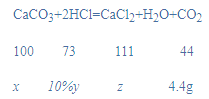
![]() x=10g,
x=10g,
![]() y=73g,
y=73g,
![]() z=11.1g,
z=11.1g,
反应后所得溶液的溶质质量分数= ![]() ×100%≈16.3%;
×100%≈16.3%;
答:(1)需要浓盐酸 22.9mL,水(密度为1gmL-1) 78.0mL;
(2)所取混合物中碳酸钙的质量为10g,所加稀盐酸的质量为73g,反应后所得溶液的溶质质量分数是16.3%。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】小明学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体。但他在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体。
提出问题:为什么会生成淡黄色固体?
查阅资料:小明同学查阅资料,记录了下列几种物质的颜色:
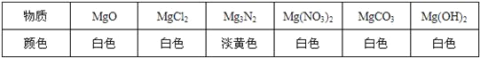
其他同学认为不必查阅氯化镁(MgCl2)的颜色,理是_______;
提出猜想:分析资料,小明认为淡黄色固体可能是镁条与空气中的______反应生成的。
实验探究:小明设计以下实验用于验证猜想
实验步骤 | 实验现象 | 实验结论 |
将燃着的镁条伸入装有纯净氮气的集气瓶中; | ①镁条在氮气中____, ②产生_________; | 镁条能与氮气反应生成氮化镁。 |
拓展与迁移:如果用镁条代替红磷完成测定空气中氧气含量的实验,对实验结论造成的影响是____。