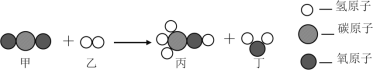
��Ŀ����
����Ŀ��21�����Ǻ��������õ����͡��ҹ��滮ȷ��������ɫ��������չս�ԣ�����ѧ��Դ���ۺ����ý����ص㷢չ����֮һ��
��һ����ˮ��������������ˮ�����ú�ˮ�и��ɷݵ�______��ͬ�������ˮˮ����ѹ����Ĥ��������ˮ�����ú�ˮ�и��ɷݵ�______��ͬ�������ˮ��
����������
��1���ƴ��Ρ���ͼ��ʾ�����ú�ˮ��ȡ���εĹ��̣�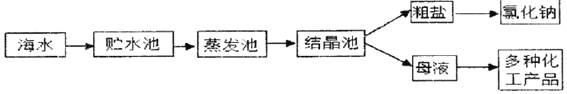
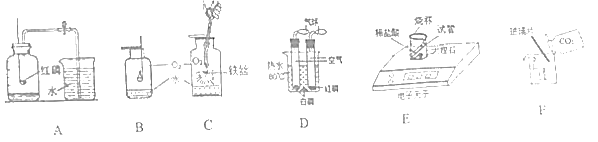
�ٸ��ݺ�ˮɹ�ε�ԭ��������˵������ȷ����______������ĸ��
A����ˮ������ˮ�أ���ˮ�ijɷֻ�������
B�����������У���ˮ���軯�Ƶ����������ӣ�
C�����������У���ˮ��ˮ�����������ӣ�
D������������ĸҺ���Ȼ��Ƶı�����Һ��
�ڴ�±ˮ����ȡ�����õĽᾧ������______
��2�����δ����������к�����ɳ������þ���Ȼ��Ƶ����ʡ�����������ˮ��Ȼ��ͨ�����²������ɵõ��ϴ����Ȼ��ƣ�a���ˡ�b�ӹ�����Ba��OH��2��Һ��c�����������d�ӹ�����Na2CO3��Һ��e��������ȷ�IJ���˳����______������ĸ����
�������Ƽ����ƴ��������ͼ��ͼ��

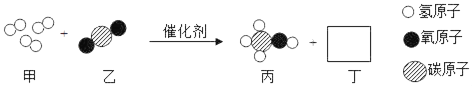
��1����������������̼�ữ��ԭ����______
��2��д���ܲ����з����Ļ�ѧ����ʽ______
���ģ���þ������þ�㷺Ӧ�����������������ҵ����±ˮ����ȡþ�Ĺ�����ͼ��ʾ��
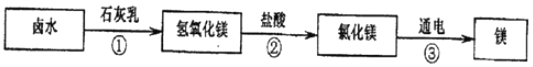
������ת�������У��ٴ��������ķ�Ӧ����______��Ӧ�������к��������ֽ��������������ֽ���֮һ�����ڴ������Ļ�ѧ����ʽ______��
���𰸡��е� ������С AD �����ܼ����ᾧ bdace ��Ϊ���Ͱ���ˮ�Լ��ԣ��ȱ���ʳ��ˮ���������ն�����̼�����������̼�������� 2NaHCO3![]() Na2CO3+H2O+CO2�� ���ֽ� Mg��OH��2+2HCl=MgCl2+2H2O
Na2CO3+H2O+CO2�� ���ֽ� Mg��OH��2+2HCl=MgCl2+2H2O
��������
��һ����������ˮ�����ú�ˮ�и��ɷݵķе�Ƚϸߣ�ˮ�ķе�Ƚϵͽ��з���ġ���������ˮ�����ú�ˮ�и��ɷݵķе㲻ͬ�������ˮ����ѹ����Ĥ��������ˮ�����ú�ˮ�и��ɷݵĿ�����С��ͬ��ˮ���ӿ���ͨ������Ĥ���������Ӳ���ͨ����
��������1����A����ˮ������ˮ�أ���ˮ�ijɷֻ������䣬��A��ȷ��
B�����������У�ˮ��������ˮ���Ȼ��Ƶ��������䣬��B����
C���������������ˮ�ֵ���������ˮ��ˮ���������٣���C����
D������������ĸҺ���Ȼ��Ƶı�����Һ����D��ȷ����ѡAD��
����Ϊ�Ȼ��Ƶ��ܽ�����¶ȵı仯�������Բ��������ܼ����ᾧ��
��2��Ҫ��ȥ�����к��е����ʣ���������������þ��Ӧ�������ᱵ������������þ���������Լӹ���������������Һ��ȥ����þ��̼�������Ȼ��Ʒ�Ӧ�����Ȼ��ƺ�̼��Ƴ�����̼����������������Ӧ�����������ƺ�̼�ᱵ�������ӹ�����Na2CO3��Һ��ȥ�Ȼ��ƺ����Լ�����������ͨ�����˰Ѳ�����ˮ�����ʳ�ȥ��̼���������ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼���������������ȥ������̼���ƣ������������Ȼ������壬��ͨ��������ȥ����ȷ�IJ���˳����bdace��
��������1����Ϊ���Ͱ���ˮ�Լ��ԣ��ȱ���ʳ��ˮ���������ն�����̼���������ð��������������У�Ҫ����ʳ��ˮ��ͨ�백�����Ƴɱ��Ͱ���ˮ����������ͨ�������̼��
��2��������з�Ӧ��̼�������ڼ��ȵ������·ֽ�Ϊ̼���ơ�ˮ�Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ��2NaHCO3![]() Na2CO3+H2O+CO2����
Na2CO3+H2O+CO2����
���ģ��ٴ������ķ�Ӧ�ǣ��Ȼ�þ���������Ʒ�Ӧ�����Ȼ��ƺ�������þ�������÷�Ӧ�������ֻ����ﻥ�ཻ���ɷ֣������������ֻ�����ķ�Ӧ�������������ĸ��ֽⷴӦ���ڴ������ķ�Ӧ��������þ�����ᷴӦ�����Ȼ�þ��ˮ����Ӧ�Ļ�ѧ����ʽΪ��Mg��OH��2+2HCl=MgCl2+2H2O��

 ��У����ϵ�д�
��У����ϵ�д�