题目内容
【题目】氢氧化钠是重要的工业原料,也是实验室的常用药品
(一)小明和小芳对氢氧化钠做了如下探究:
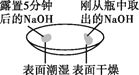
实验1 | 观察固体表面 |
|
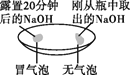
实验2 | 向两块固体表面滴加足量的稀盐酸 |
|
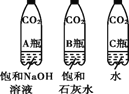
实验3 | 振荡3个塑料瓶 |
|
(1)由实验1、2可知,氢氧化钠会吸收空气中的__________而发生变化,因此要密封保存。
(2)实验3中观察到塑料瓶变瘪的程度为A>B>C,对比A瓶与C瓶的实验现象,可证明____________,C中的反应方程式为____________。
(二)小明取密封的氢氧化钠溶液并向其中加入稀硫酸,该中和反应的实质是_________________ ;然后,对反应后废液的溶质进行了如下探究:
(提出问题)氢氧化钠溶液和稀硫酸反应后,溶质是什么?
(查阅资料)硫酸钠溶液呈中性。
(猜想假设)猜想1 硫酸钠和氢氧化钠; 猜想2 硫酸钠和硫酸 猜想3 __________。
(设计实验)
实验操作 | 实验现象 | 实验结论 |
①取少量废液于试管中,滴入几滴酚酞试液 | 溶液无明显变化 | 猜想_____不成立 |
②另取少量废液于试管中,滴入几滴氯化钡溶液 | ___________________ | 猜想2成立 |
(反思与评价)(1)小芳认为实验操作②得出的结论不成立,她的理由是_________。
(2)为了证明猜想2成立,可以向废液中加入少量氧化铜粉末,原因是__________(用化学方程式表示)。
【答案】水和二氧化碳 氢氧化钠与二氧化碳发生反应 H2O+CO2= H2CO3 氢离子与氢氧根离子结合生成水分子 硫酸钠 1 溶液变浑浊 氯化钡与硫酸钠反应生成不溶于水的硫酸钡 CuO+H2SO4=CuSO4+H2O
【解析】
(1)由实验1可知,氢氧化钠固体易潮解;由实验2可知,氢氧化钠吸收空气中的二氧化碳生成了碳酸钠,即氢氧化钠会吸收空气中的水和二氧化碳而发生变化,因此要密封保存;故填:水和二氧化碳。
(2)实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生的反应是:二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,对比A瓶与C瓶的实验现象,可证明CO2能与NaOH发生反应;C中二氧化碳能与水反应生成碳酸;故填:氢氧化钠与二氧化碳发生反应;H2O+CO2= H2CO;
(二)小明向氢氧化钠溶液中加入稀硫酸,氢氧化钠和稀硫酸反应生成硫酸钠和水,该中和反应的实质是氢氧根离子和氢离子结合生成水。
故填:氢离子与氢氧根离子结合生成水分子;
[猜想假设]氢氧化钠与硫酸恰好中和时,溶液中的溶质只有硫酸钠;当氢氧化钠过量时,溶液中的溶质有硫酸钠和氢氧化钠;当硫酸过量时,溶液中的溶质有硫酸钠和硫酸;故填:硫酸钠;
[设计实验]①取少量废液于试管中,滴入几滴酚酞试液,无明显现象,说明溶液中不含有氢氧化钠;
②另取少量废液于试管中,滴入几滴氯化钡溶液,产生白色沉淀,说明钡离子和硫酸根离子反应生成了硫酸钡,实验过程如下所示:
实验操作 | 实验现象 | 实验结论 |
①取少量废液于试管中,滴入几滴酚酞试液 | 溶液无明显变化 | 猜想1不成立 |
②另取少量废液于试管中,滴入几滴氯化钡溶液 | 产生白色沉淀 | 猜想2成立 |
[反思与评价](1)反应后的溶液中一定含有硫酸钠,而氯化钡也能与硫酸钠反应生成不溶于水的硫酸钡白色沉淀,所以实验操作②得出的结论不成立;故填:氯化钡与硫酸钠反应生成不溶于水的硫酸钡白色沉淀;
(2)为了证明猜想Ⅱ成立,可以向废液中加入少量氧化铜粉末,原因是氧化铜和稀硫酸反应生成硫酸铜和水,过程中氧化铜溶解,溶液由无色变成蓝色,反应的化学方程式为:CuO+H2SO4=CuSO4+H2O。