题目内容
【题目】下图是实验室配制一定溶质质量分数的NaCl溶液的流程图。
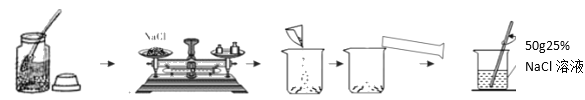
请回答:
(1)应称量________gNaCl,需加水________mL。
(2)若称量NaCl固体时指针向右偏转,则应_____直到天平平衡。
(3)取上述溶液20g加入蒸馏水,稀释到_______g,可得到5%的NaCl溶液。
【答案】12.5 37.5 继续向左盘添加氯化钠 80
【解析】
(1)利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;再根据溶剂质量=溶液质量-溶质质量即可求得水的质量。
(2)使用托盘天平称量药品时应遵循“左物右码”,指针偏右,说明药品质量小于砝码质量,据此进行分析解答。
(3)根据溶液稀释前后溶质的质量不变,进行分析解答。
(1)溶质质量=溶液质量×溶质的质量分数,配制10%的氯化钠溶液50g,需氯化钠的质量=50g×25%=12.5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=50g-12.5g=37.5g(合37.5mL)。
(2)在称量氯化钠固体的过程中,步骤应该是:先调好砝码和游码,然后向左边托盘添加固体物质;若发现指针向右偏转,说明固体物质药品的质量小于砝码的质量,故应继续向左盘添加氯化钠,直至天平平衡。
(3)设要加水的质量为x,根据溶液稀释前后溶质的质量不变,
则20g×25%=(20g+x)×5%
x=80g
故取上述溶液20g加水稀释到20g+80g=100g。
答案:
(1)12.5; 37.5;
(2)继续向左盘添加氯化钠;
(3)100

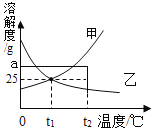
【题目】KCl与KNO3在不同温度的溶解度数据如表.则下列说法正确的是( )
温度/℃ | 10 | 20 | 30 | 40 | 50 |
KCl | 30g | 33g | 35g | 38g | 41g |
KNO3 | 21g | 31g | 45g | 65g | 88g |
A.KNO3比KCl的溶解度大
B.两物质的溶解度相等的温度在20~30℃之间
C.在20℃时,10g水中加入5g KCl可得到33.3%的KCl溶液
D.在50℃时,两物质各5g分别加入10g水中,充分溶解,均有固体剩余