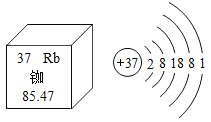
题目内容
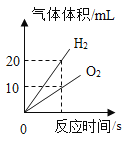
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响。按照如下方案完成实验。测量得到氧气的体积与时间的关系如图所示。
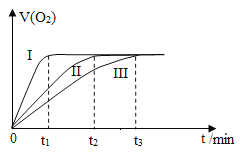
实验 | 反应物 | 催化剂 | 温度 | 氧气体积与时间的关系 |
① | 10mL10%H2O2溶液 | 无 | 25°C | Ⅳ |
② | 10mL20%H2O2溶液 | 无 | 25°C | Ⅲ |
③ | 10mL20%H2O2溶液 | 无 | 40°C | Ⅱ |
④ | 10mL20%H2O2溶液 | 1~2滴饱和FeCl3溶液 | 40°C | Ⅰ |
回答下列问题:
(1)写出H2O2分解的反应方程式:______。
(2)对比实验③和④的目的是_____ 。
(3)通过对比实验②和③,所得出的实验结论是___。
(4)请在图A中画出实验①测量得到氧气的体积与时间的关系曲线Ⅳ___。
【答案】 探究催化剂对反应速率的影响 其他条件不变,升高温度,可加快反应速率
探究催化剂对反应速率的影响 其他条件不变,升高温度,可加快反应速率 
【解析】
(1)过氧化氢在二氧化锰作催化剂条件下分解生成氧气和水,反应的方程式为: 。故填:
。故填: ;
;
(2)根据表中数据可知,实验③④中反应物浓度、反应温度相同,而实验④使用了催化剂,所以对比实验③和④的目的是探究催化剂对反应速率的影响。故填:探究催化剂对反应速率的影响;
(3)根据表中数据可知,实验②和③中温度不同,其他条件相同,在40℃时产生氧气的速率更快,通过对比实验②和③,所得出的实验结论是其他条件不变,升高温度,可加快反应速率。故填:其他条件不变,升高温度,可加快反应速率;
(4)对比实验①和②,其他条件相同,不同的是实验②的过氧化氢浓度大于实验①的浓度,所以实验①生成氧气的速率小于实验②生成氧气的速率,同时生成的氧气也比实验②少,据此作图为: 。
。
故填: 。
。

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目