题目内容
【题目】小余阅读课外资料得知:双氧水分解除了用二氧化锰(MnO2)还可用氧化铜(CuO)等物质作催化剂,于是他对氧化铜产生了探究兴趣.
(提出问题)氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
(设计实验)小余以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)
实验序号 | 氯酸钾质量 | 其他物质质量 | 待测数据 |
① | 1.2g | / | |
② | 1.2g | CuO 0.5g | |
③ | 1.2g | MnO2 0.5g |
①上述实验应测 量的“待测数据”是________________ .
②若实验②比实验①的“待测数据”____________ (填“大”或“小”),说明氧化铜能加快氯酸钾的分解.
③将实验②反应剩余的固体取出后经洗涤、干燥,再次精确称量得到0.5g黑色粉末,这样做的目的是____________,小余同学认为氧化铜肯定是氯酸钾分解的催化剂,但小淳同学对此提出了异议,小淳同学设计了如下实验:将第二次精确称量得到的0.5g黑色粉末和1.2g氯酸钾混合放入试管中,加热,伸入带火星木条,发现木条很快复燃.小淳同学这样做目的是____________;
(预期结论)氧化铜也能作氯酸钾的催化剂.
(评价设计)你认为小余设计实验③和实验②对比的目的是____________; 写出实验②反应的化学方程式________
【答案】时间 小 证明反应前后氧化铜的质量不变 证明反应前后氧化铜的化学性质不变 证明二氧化锰和氧化铜的催化效果哪个较好 2KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
【解析】
(1)根据控制变量法,要测定二氧化锰(MnO2)和氧化铜(CuO)的催化效果,要将其他的条件控制的相同,即氯酸钾的质量相等,温度相等,催化剂的质量相等的条件下,测量生成等体积的氧气需要时间的大小,时间越短,催化效果越好。
(2)实验的结论是氧化铜能加快氯酸钾的分解,故实验②比实验①的“待测数据小,说明氧化铜起到了催化作用。
(3)氧化铜在该实验中改变了反应的速率,为了证明氧化铜起催化作用,改变了反应的速率,而不是参加反应改变了反应速率,故需要测定氧化铜在反应前后的质量和化学性质不变,故该步骤是为了证明反应前后氧化铜的质量不变。第2次将0.5g的氧化铜与氯酸钾反应,发现木条复燃,说明第1次反应后的氧化铜的化学性质没有改变。
(4)实验3和实验2分别是用等质量的二氧化锰和氧化铜作催化剂,故对比的目的是为了证明二氧化锰和氧化铜的催化效果哪个较好。实验2是氯酸钾在氧化铜作催化剂的条件下加热生成氯化钾和氧气,该反应的化学方程式为:2KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑

 举一反三期末百分冲刺卷系列答案
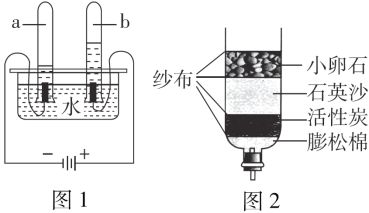
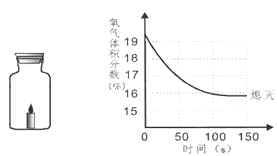
举一反三期末百分冲刺卷系列答案【题目】某化学兴趣小组的同学按照课本上的实验装置做“测定空气中氧气的体积分数”实验(如图所示),但测出的氧气的体积分数明显小于1/5。请你参与探究:

(提出问题)造成误差的原因是什么?如何改进课本上的实验装置?
(查阅资料)红磷、白磷的一些性质如下表:
颜色、状态 | 熔点/℃ | 着火点/℃ | 密度/(g/cm3) | |
红磷 | 暗红色固体 | 590 | 240 | 2.34 |
白磷 | 白色或黄色固体 | 44.1 | 40 | 1.82 |
(猜想与假设)
甲同学:可能是导管内原含有空气,后来留有吸入的水,影响实验的准确性。
乙同学:可能是瓶内残留气体中还有氧气。
你还能作出的猜想是_____ ;___________(两个)。
(交流与讨论)
(1)丙同学认为用木炭代替红磷,他的猜想不合理,理由是______
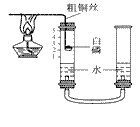
(2)他们对课本上的实验装置进行了右图所示的改进(其他仪器忽略)。
①甲同学提出应把红磷换为白磷,则白磷燃烧文字表达式________。
②与课本上的实验装置相比较,该装置的两个优点是________;___。