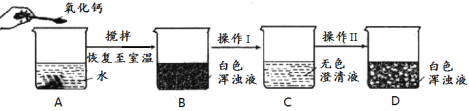
题目内容
【题目】下列除杂(括号内为杂质)的方法和原理正确的是
A. CO2(H2):2H2+O2![]() 2H2O B. N2(O2):2Cu+O2
2H2O B. N2(O2):2Cu+O2![]() 2CuO
2CuO
C. Al(Fe):Fe+2HCl==FeCl2+H2↑ D. KCl(KClO3):2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
【答案】B
【解析】
A、除去二氧化碳中的氢气不能够点燃,这是因为会引入新的气体杂质,且当二氧化碳(不能燃烧、不能支持燃烧)大量存在时,少量的氢气是不会燃烧的,故选项所采取的方法错误;
B、氧气通过灼热的铜网时可与铜发生反应生成氧化铜,而氮气不与铜反应,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确;
C、Fe和Al均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误;
D、氯酸钾在加热和二氧化锰做催化剂下生成氯化钾和氧气,能除去氯酸钾且引入新的杂质二氧化锰,不符合除杂原则,故选项所采取的方法错误。
故选B。

【题目】第七组同学在探究锌、铁、铜三种金属活动性顺序中,又发现影响化学反应的剧烈程度的因素。探究过程如下:
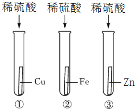
(1)甲同学分别取等量的稀硫酸与足量的相同大小的三种金属进行如右图所示实验。该实验可通过观察是否产生气泡及产生气泡的快慢,判断金属活动性为Zn>Fe>Cu。同时可说明化学反应剧烈程度还与______有关。
(2)乙同学用一只试管,取一次稀硫酸和足量的铜片、铁片、锌片, 通过设计如下的实验方案进行金属活动性顺序的判定。填写下表内容:
实验步骤 | 观察到的现象 |
① 取少量稀硫酸于试管中,插入足量铁片,充分作用 | __________,溶液由无色变为浅绿色 |
② 在①反应后溶液中插入______________,充分作用 | 无明显现象 |
③ 在②所得的溶液中插入______________,充分作用 | ___________,溶液由浅绿色变成无色 |
写出实验步骤③中涉及反应的化学方程式:____________
(3)丙同学认为在乙同学设计的方案中,只要补充一个实验,还可得出Zn>Fe>H>Cu的结论。丙同学要补充的实验是_____。
(4)丁同学认为不必做补充实验,只需在乙同学方案中调整插入金属的顺序,即可得到Zn>Fe>H>Cu的结论,你认为调整后插入金属的实验顺序是__________。