题目内容
【题目】第七组同学在探究锌、铁、铜三种金属活动性顺序中,又发现影响化学反应的剧烈程度的因素。探究过程如下:
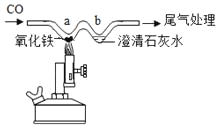
(1)甲同学分别取等量的稀硫酸与足量的相同大小的三种金属进行如右图所示实验。该实验可通过观察是否产生气泡及产生气泡的快慢,判断金属活动性为Zn>Fe>Cu。同时可说明化学反应剧烈程度还与______有关。
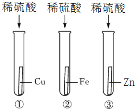
(2)乙同学用一只试管,取一次稀硫酸和足量的铜片、铁片、锌片, 通过设计如下的实验方案进行金属活动性顺序的判定。填写下表内容:
实验步骤 | 观察到的现象 |
① 取少量稀硫酸于试管中,插入足量铁片,充分作用 | __________,溶液由无色变为浅绿色 |
② 在①反应后溶液中插入______________,充分作用 | 无明显现象 |
③ 在②所得的溶液中插入______________,充分作用 | ___________,溶液由浅绿色变成无色 |
写出实验步骤③中涉及反应的化学方程式:____________
(3)丙同学认为在乙同学设计的方案中,只要补充一个实验,还可得出Zn>Fe>H>Cu的结论。丙同学要补充的实验是_____。
(4)丁同学认为不必做补充实验,只需在乙同学方案中调整插入金属的顺序,即可得到Zn>Fe>H>Cu的结论,你认为调整后插入金属的实验顺序是__________。
【答案】物质本身的性质(合理即可) 铁片表面有气泡生成 铜片 锌片 锌片表面有黑色固体产生 Zn+FeSO4═ZnSO4+Fe 将铜片插入稀硫酸溶液中 铜,铁,锌
【解析】
(1)该实验可通过观察是否产生气泡及产生气泡的快慢,产生气泡的比不产生气泡的活泼,产生气泡快的比产生气泡慢的活泼,由此判断金属活动性为Zn>Fe>Cu.同时可说明化学反应剧烈程度还与物质本身的性质有关;
(2)①取少量稀硫酸于试管中,插入足量铁片,充分作用,产生气泡,溶液由无色变为浅绿色,说明铁在金属活动性顺序中排在氢前面;
②在①反应后溶液中插入铜片,充分作用,无明显现象,说明铜不如铁活泼;
③在②所得的溶液中插入锌片,充分作用,锌片表面有黑色固体析出,溶液由浅绿色变成无色,说明锌比铁活泼;实验步骤③中锌和硫酸亚铁反应生成硫酸锌和铁,反应的化学方程式为:Zn+FeSO4═ZnSO4+Fe;
(3)丙同学要补充的实验是将铜片插入稀硫酸中,无明显现象,说明铜不能和稀硫酸反应,即在金属活动性顺序中铜排在氢后面;
(4)调整后插入金属的实验顺序是铜片、铁片、锌片,插入铜片时无明显现象,说明铜排在氢后面,插入铁片时产生气泡,说明铁排在氢前面,插入锌片时,锌片表面析出黑色固体,是因为锌和硫酸亚铁反应生成硫酸锌和铁,说明锌比铁活泼,因此Zn>Fe>H>Cu。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】某密闭容器中有X、O2、CO2和 H2O四种物质,在一定条件下充分反应, 测得反应前后各物质的质量如下表。下列说法正确的是 ( )
物 质 | X | O2 | CO2 | H2O |
反应前的质量/g | 1.6 | 8 | 2.2 | 1.8 |
反应后的质量/g | 0 | 1.6 | 待测 | 5.4 |
A. 该反应可能是化合反应 B. 表中“待测”数据为 4.4
C. 反应中的X 与 O2 变化的质量比是 1:4 D. X可能是乙醇