题目内容
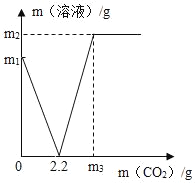
【题目】某兴趣小组用10g镁条与一定溶质质量分数的稀硫酸反应,测得产生氢气的质量与稀硫酸的质量关系如图所示(假设镁条中除表面含有氧化镁外,没有其他杂质)
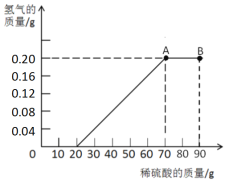
(1)如图B点溶液中含有的阳离子有_________________(用符号表示)。
(2)用化学方程式说明当加入的稀硫酸质量为10g时,为什么不产生氢气: ______________
(3)计算所用稀硫酸的溶质质量分数。______________(写出计算过程)
【答案】Mg2+ H+MgO+H2SO4==MgSO4+H2O19.6%。
【解析】
⑴B点溶液溶质为硫酸镁,还有过量的稀硫酸,故含有的阳离子为镁离子和氢离子;
⑵由于镁条表面附有氧化镁,故稀硫酸先与氧化镁反应生成硫酸镁和水,不生成氢气,反应方程式为:MgO+H2SO4==MgSO4+H2O;
⑶从20g到70g加入50g稀硫酸,反应生成0.2g氢气,即氢气的量为0.1,根据化学方程式可知,每生成一分子氢气就要消耗一分子硫酸,故硫酸的质量为0.1×(1×2+32+16×4)=9.8g,其质量分数为:9.8÷50×100%=19.6%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目