题目内容
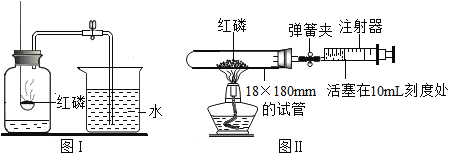
【题目】一种焰火火药中所含的硝酸铜在燃放时发生如下反应: 2Cu(NO3)2 ![]() 2uO+O2↑+4X↑,其中X是密度度大于氧气的气体。已知相同状况下气体的体积比等于其分子个数比。同学们利用如图装置对该反应展开探究。下列说法正确的是
2uO+O2↑+4X↑,其中X是密度度大于氧气的气体。已知相同状况下气体的体积比等于其分子个数比。同学们利用如图装置对该反应展开探究。下列说法正确的是
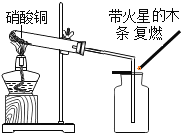
①X的化学式是NO; ②试管中固体逐渐变黑;③使带火星木条复燃的是O2;④实验证明X能支持燃烧
A. ①②B. ②③C. ③④D. ②④
【答案】D
【解析】
① 根据质量守恒定律,反应前后各种原子个数相等,X的化学式是NO2,此选项错误;
② 反应生成黑色的氧化铜固体,所以试管中固体逐渐变黑,此选项正确;
③ 硝酸铜分解生成的气体中,NO2与O2的体积比是4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成的气体能使带火星的木条复燃,而空气不能,说明NO2有助燃性,所以能使带火星木条复燃的是NO2,此选项错误;
④ 已经确定出X是NO2,硝酸铜分解生成的气体中,NO2与O2的体积比是4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成的气体能使带火星的木条复燃,而空气不能,说明NO2有助燃性,实验证明X能支持燃烧,此选项正确。故选D。

练习册系列答案
 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目