题目内容
【题目】把一定量氧化铜和0.8g氧化镁的混合物投入到溶质质量分数为9.8%的稀硫酸中,待固体完全溶解后,再往溶液里加入溶质质量分数为8%的NaOH溶液,生成沉淀质量与加入溶液质量关系如图所示。下列说法中正确的是
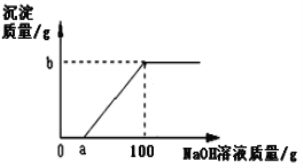
A. 稀硫酸的质量为120 g
B. a的取值范围为0< a<60
C. 当a值为60时,b值为4.8 g
D. 混合物的质量可能为7.0 g
【答案】D
【解析】氧化铜、氧化镁和稀硫酸、硫酸铜、硫酸镁和氢氧化钠反应的化学方程式为:
CuO+H2SO4═CuSO4+H2O,MgO+H2SO4═MgSO4+H2O,CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,
A、由以上反应关系可知,H2SO4~2NaOH,
设稀硫酸中硫酸质量为x,
H2SO4~2NaOH,
98 80
x100g×8%
![]()
x=9.8g,
稀硫酸的质量为![]() =100g,
=100g,
该选项说法错误;
B、由以上反应关系可知,MgO~H2SO4,
设氧化镁消耗硫酸的质量为y,
MgO~H2SO4,
40 98
0.8g y
![]()
y=1.96g,
剩余硫酸质量小于:100g×9.8%-1.96g=7.84g,
设剩余硫酸消耗氢氧化钠的质量最多为z,
H2SO4~2NaOH,
98 80
7.84g z
![]()
z=6.4g,
a的值小于:6.4g÷8%=80g,因此a的取值范围为0<a<80,
该选项说法错误;
C、当a值为60时,和硫酸铜、硫酸镁反应的氢氧化钠质量为:(100g-60g)×8%=3.2g,
设3.2g氢氧化钠完全和硫酸铜反应时生成氢氧化铜质量为n,完全和硫酸镁反应时生成氢氧化镁质量为p,
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,
80 98 80 58
3.2g n 5.6g p
![]()
![]()
n=3.92g,p=2.32g,
由计算可知,2.32<b<3.92,因此当a值为60时,b值不可能为4.8,该选项说法错误;
D、混合物的质量为7.0g时,氧化铜质量为:7.0g-0.8g=6.2g,
设氧化铜消耗硫酸质量为m,
CuO+H2SO4═CuSO4+H2O,
80 98
6.2g m
![]()
m=7.595g,
则氧化铜和氧化镁消耗硫酸质量为:7.595g+1.96g=9.555g,
剩余硫酸质量为:100g×9.8%-9.555g=0.245g<7.84g,
该选项说法正确。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案