题目内容
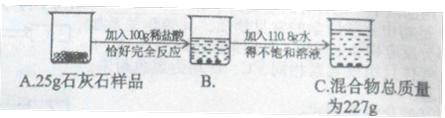
【题目】实验中学化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。
请根据以上信息计算:
(1)样品中碳酸钙的质量分数?
(2)C烧杯中溶液的溶质质量分数?
【答案】(1)80%; (2)10%
【解析】
试题分析: 已知量:石灰石样品25g;100g稀盐酸;加水110.8g;所得烧杯中混合物227g;未知量:碳酸钙;所得溶液的溶质质量、溶质质量分数;分析过程如下:因为已知物质都是混合物的质量,利用质量守恒定律计算生成二氧化碳的质量,再结合化学方程式计算出碳酸钙、氯化钙的质量,即可解答。解题过程如下:解:生成CO2的质量为:25g+100g+110.8g-227g=8.8g
设该石灰石样品中CaCO3的质量为x,生成的CaCl2的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
X y 8.8g
![]()
X=20g y=22.2g
(1)样品中碳酸钙的质量分数为:![]() ×100=80%
×100=80%
(2)C烧杯中溶液的溶质质量分数为:![]() ×100%=10%
×100%=10%
答:样品中碳酸钙的质量分数为80%,C烧杯中溶液的溶质质量分数为10%。

练习册系列答案
相关题目
【题目】对下列各主题知识的整理完全正确的是( )
A | 环境保护 | B | 生活常识 |
废旧电池——随意丢弃 工业污水——处理后排放 | 防煤气中毒——室内放一盆水 人体缺铁——引起缺铁性贫血 | ||
C | 化学反应类型 | D | 性质与用途 |
盐酸和石灰水混合——中和反应 一氧化碳还原氧化铁——置换反应 | 甲烷有可燃性——用作燃料 活性炭有吸附性——用于净化水 |