题目内容
【题目】小明为探究Cu、Al、Ag的金属活动性顺序,做了以下两个实验。
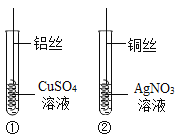
(1)试管①中观察到的现象是:铝丝表面附着一层_____________色固体,溶颜色逐渐变浅。反应的化学方程式为_______________________________。
(2)试管②中观察到的现象是:铜丝表面附着一层银白色固体,溶夜逐渐变为__________色。反应的化学方程式为_______________________________。
【答案】(紫)红  蓝
蓝 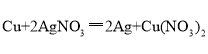
【解析】
(1).铝丝会和硫酸铜溶液发生反应将Cu从溶液中置换出来并附在铝丝上,所以铝丝的表面会附着一层红色固体;
(2).铝丝与硫酸铜反应的化学方程式为:  ;
;
(3).铜丝会和AgNO3溶液发生置换反应,生成白色的银单质和蓝色的CuSO4溶液;
(4). 铜丝和AgNO3溶液发生置换反应的化学方程式为: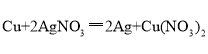 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】测定合金中铜的质量分数。为测定某铜、锌合金中铜的质量分数,兴趣小组同学称取20g合金于烧杯中,将80g稀盐酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀盐酸的质量(g) | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量(g) | 39.92 | 59.84 | 79.80 | 99.80 |
(1)该铜、锌合金中铜的质量分数为_____________? (写出计算过程)
(2)第三次加入稀盐酸后烧杯内溶液中的溶质为________________(写化学式)。
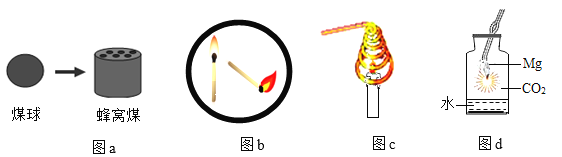
【题目】化学兴趣小组为验证质量守恒定律,做镁条在空气中燃烧的实验(如图1)。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。

(1)镁条燃烧的化学方程式是_____;
(2)同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量。小马认为这个反应不遵循质量守恒定律。你_____(“同意”或“不同意”)他的观点。你认为出现这样实验结果的原因可能是_____。
(3)小红按如图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
(提出问题)黄色固体是什么?
(查阅资料)①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)
固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(做出猜想)黄色固体是Mg3N2
(实验探究)请设计实验,验证猜想
实验操作 | 实验现象 | 实验结论 |
将收集到的黄色固体放入试管中,加入适量的_____,在试管口放置湿润红色石蕊试纸。 | ①_____; ②_____。 | 黄色固体是Mg3N2 |
(反思与交流)空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是_____。