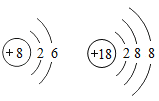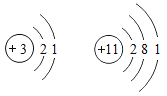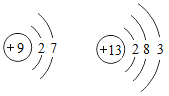题目内容
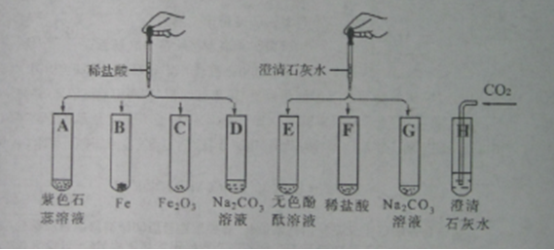
【题目】潜水器中可使用过氧化钠(Na2O2)固体做供氧剂,过氧化钠固体与二氧化碳反应原理是:2Na2O2+2CO2═2Na2CO3+O2,为验证该反应产物,某兴趣小组进行如下实验探究。
(查阅资料)过氧化钠与水反应生成氢氧化钠和氧气。
(设计实验)小组同学利用如图装置进行实(忽略稀盐酸的挥发)。
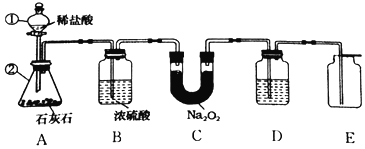
(1)装置A中标号仪器名称:①________,②________。
(2)装置A中反应的化学方程式为________。
(3)装置B的作用是________。
(4)为防止装置E收集的氧气中混有二氧化碳,装置D中盛放的试剂是________溶液。
(5)验证过氧化钠与二氧化碳反应产物
步骤 | 实验操作 | 实验现象 | 实验结论 |
① | 将带火星的木条伸入装置E中 | _____ | 产物中有氧气 |
② | 反应后取装置C中少量固体于试管中,加水完全溶解 | _____ | 固体中有未反应的过氧化钠 |
③ | 向步骤②反应后所得溶液中加入足量稀盐酸,有气体产生,将产生的气体通入足量澄清石灰水中 | _____ | 产物中有碳酸钠 |
【答案】分液漏斗 锥形瓶 ![]() 吸收水蒸气 氢氧化钠 木条复燃 有气泡产生 澄清石灰水变浑浊
吸收水蒸气 氢氧化钠 木条复燃 有气泡产生 澄清石灰水变浑浊
【解析】
过氧化钠固体与二氧化碳反应生成碳酸钠和氧气,过氧化钠与水反应生成氢氧化钠和氧气,二氧化碳能使澄清石灰水变浑浊,氧气能使带火星的木条复燃。
(1)装置A中标号仪器名称:①分液漏斗,②锥形瓶。
(2)装置A中反应是稀盐酸和石灰石反应生成碳酸钙和二氧化碳,反应的化学方程式为![]() 。
。
(3)浓硫酸具有吸水性,故装置B的作用是吸收水蒸气。
(4)氢氧化钠和二氧化碳反应生成碳酸钠和水,为防止装置E收集的氧气中混有二氧化碳,装置D中盛放的试剂是氢氧化钠溶液。
(5) 过氧化钠固体与二氧化碳反应生成碳酸钠和氧气,过氧化钠与水反应生成氢氧化钠和氧气,二氧化碳能使澄清石灰水变浑浊,氧气能使带火星的木条复燃,稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳。
步骤 | 实验操作 | 实验现象 | 实验结论 |
① | 将带火星的木条伸入装置E中 | 木条复燃 | 产物中有氧气 |
② | 反应后取装置C中少量固体于试管中,加水完全溶解 | 有气泡产生 | 固体中有未反应的过氧化钠 |
③ | 向步骤②反应后所得溶液中加入足量稀盐酸,有气体产生,将产生的气体通入足量澄清石灰水中 | 澄清石灰水变浑浊 | 产物中有碳酸钠 |

【题目】以下是某兴趣小组探究酸、碱性质的部分片段,请你一起参与探究。
(1)在白色点滴板的A、B两凹槽内分别加入少量稀硫酸、氢氧化钙溶液,然后分别滴加紫色石蕊溶液,则A、B凹槽内溶液颜色分别为____________、____________。
(2)在盛有稀硫酸的试管里放入一根生锈 (铁锈的主要成分是Fe2O3)的铁钉,过一会取出铁钉,用水洗净,铁钉表面变得很光亮,溶液颜色变成了____________色,利用此反应可清除铁锈,除锈的原理用化学方程式表示为__________________。但除锈时不适宜将生锈的铁制品长时间浸泡在稀硫酸中,原因是(用化学方程式表示)___________________________。
(3)兴趣小组成员在准备探究氢氧化钠性质的时候,发现了一瓶上个月做实验用的氢氧化钠忘记了盖瓶盖,对于该固体是否变质,同学们提出了假设并通过如下实验来验证假设, 请完成表格。
实验者 | 实验操作 | 实验现象 | 实验结论 | 实验评价与反思 |
小军 | 取少量固体溶于水,制成溶液,向溶液中滴加稀盐酸 | 发现有气体生成 | 全部变质,白色固体是碳酸钠 | 结论错误。原因是______________。 |
小华 | 取少量固体溶于水,制成溶液,向溶液中滴加无色酚酞溶液。 | 酚酞溶液变红 | 没有变质,白色粉末是氢氧化钠 | 结论错误。原因是______________。 |
小红 | 取少量固体溶于水,制成溶液。 ①向所得溶液中滴加足量BaCl2溶液, ②然后过滤,向滤液中滴加无色酚酞溶液 | ①有__产生。 ②发现酚酞_________。 | 部分变质,白色粉末是氢氧化钠和碳酸钠 | 结论正确.①实验现象用化学方程式表示为________。 |
(4)通过探究发现,氢氧化钠在空气中不仅吸收水分,发生______________现象,还会与空气中二氧化碳发生反应,反应方程式可表示为______________,所以氢氧化钠必须密封保存。三氧化硫也能与碱反应,请写出三氧化硫与氢氧化钠反应的化学方程式______________________。