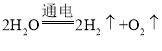题目内容
【题目】第32届夏季奥运会将在日本东京举行,其奖牌制作的原料来自于电子垃圾中提炼出来的金属。从废线路板中提炼贵重金属和制备硫酸铜晶体的一种工艺流程如下:
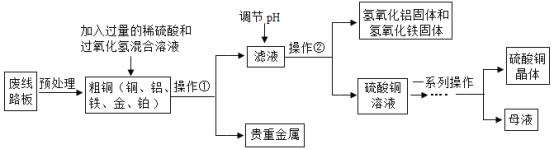
已知:在酸性环境中有过氧化氢存在时,铁和铜分别会转化为铁离子和铜离子。
(1)操作②的名称是________;
(2)提炼出的贵重金属可制作奖牌,其成分是______________;
(3)“调节pH”时加碱液会使溶液的pH________(填“增大”或“减小”),其主要目的是除去滤液中Al3+和______(填金属离子符号);
(4)写出粗铜中的铜与稀硫酸和过氧化氢的混合溶液发生反应的化学方程式:__________________。
【答案】过滤 铂和金(或Pt和Au) 增大 Fe3+ Cu+H2SO4+H2O2=CuSO4+2H2O
【解析】
(1)操作②实现了固液分离,一般选用操作为过滤;
(2)向粗铜(铁、铝、铁、铂、金)中加入过量的稀硫酸和过氧化氢溶液,其中在酸性环境中有过氧化氢存在时,铁和铜分别会转化为铁离子和铜离子,铝会和稀硫酸反应,经过过滤,提炼出的贵金属为金、铂;
(3)碱性溶液pH大于7,加入碱性溶液可使溶液pH增大;铝离子与铁离子和氢氧根离子反应生成氢氧化铝和氢氧化铁沉淀,调节pH,主要目的是除去滤液中Al3+和Fe3+;
(4)反应物为铜、硫酸与过氧化氢,生成物有硫酸铜,根据质量守恒定律,还有水生成,铜、硫酸和过氧化氢反应生成硫酸铜和水,所以反应方程式为Cu+H2SO4+H2O2=CuSO4+2H2O。

【题目】控制变量是实验探究的重要方法。下列实验设计不能达到实验目的的是( )
|
|
|
|
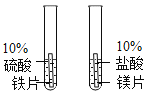
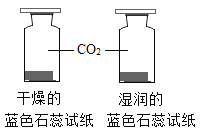
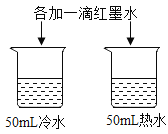
A.探究铁、镁金属活动性强弱 | B.探究二氧化碳与水是否发生反应 | C.探究不同溶剂中物质溶解性大小 | D.探究温度对分子运动快慢的影响 |
A. AB. BC. CD. D