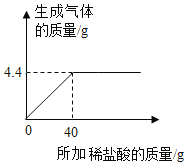
题目内容
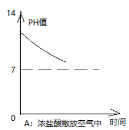
【题目】我国制碱工业先驱侯德榜发明了“侯氏制碱法”。其模拟流程如下:
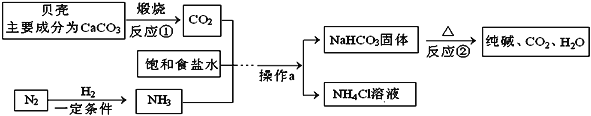
(1)贝壳属于______(填“纯净物”或“混合物”),反应②的基本反应类型为 ______。
(2)操作a的名称是______。
(3)生成的氯化铵(NH4Cl)中氮元素的化合价为______ 。
(4)工业上用分离液态空气的方法制取氮气,属于_______变化(填“物理”或“化学”)。
(5)贝壳煅烧生成的二氧化碳与甲烷CH4在一定条件下反应生成两种可燃性气体(其中一种是单质),则该反应的化学方程式为____________。
【答案】混合物 分解反应 过滤 -3 物理 CH4+CO2 ![]() 2CO+2H2
2CO+2H2
【解析】
(1)贝壳的主要成分是碳酸钙,属于混合物;反应②是碳酸氢钠固体加热条件下分解生成碳酸钠、水和二氧化碳,该反应符合“一变多”的形式,符合分解反应的特征,属于分解反应。
(2)操作a是将碳酸氢钠固体与氯化铵溶液分离,是过滤。
(3)氯化铵(NH4Cl)中铵根显+1价,氢元素显+1价,设铵根中氮元素的化合价是x,由原子团中元素的化合价代数和等于原子团的化合价,可得:x+(+1)×4=+1,则x=-3价。
(4)工业上用分离液态空气的方法,利用的液态氮和液态氧沸点的不同,属于物理变化。
(5)二氧化碳与甲烷CH4在一定条件下反应生成两种可燃性气体(其中一种是单质),由质量守恒定律,反应前后元素种类不变,另一种生成物是一氧化碳,反应的化学方程式为:CH4+CO2 ![]() 2CO+2H2。
2CO+2H2。

 阅读快车系列答案
阅读快车系列答案【题目】有位化学老师取用生石灰时,发现装满生石灰的瓶已膨胀爆裂(如图1)。化学兴趣小组对这瓶生石灰进行了如下探究:
(查阅资料):①氢氧化钙微溶于水(20℃时,100克水中最多溶解0.165克氢氧化钙)②氢氧化钙水溶液可以使无色酚酞溶液变红色。
(1)探究一:该生石灰是否变质?
(2)探究二:生石灰变质后的成分是什么?
实验操作 | 现象 | 结论和解释 |
取生石灰样品少许放入烧杯中加水搅拌插入温度计(如图2) | 形成浊液,温度___(升高、降低或不变) | 结论:生石灰已变质,解释:___。 |
猜想与假设:①氢氧化钙;②碳酸钙;③氢氧化钙和碳酸钙。
实验操作 | 现象 | 结论和解释 |
取生石灰样品少许放入烧杯中加水搅拌,过滤,向滤液中滴加酚酞溶液,向滤渣滴加足量的___(填试剂名称)。 | 滤液变___色;滤渣上产生大量气泡。 | 结论:猜想③正确。解释:生石灰变质过程中产生碳酸钙的化学方程式是___ |
(3)探究三:变质的生石灰中碳酸钙的质量分数是多少?
方案一:取10.0g样品加100克水搅拌溶解过滤将固体干燥后称量为9.8g,计算得到碳酸钙的质量分数为98.0%.方案一是否合理?___理由是___。
方案二:取10.0g样品,请设计完成方案二,同时说明要测定的量(用a表示),并计算样品中碳酸钙的质量分数。___(不要求写出计算过程)。