题目内容
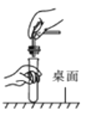
【题目】有位化学老师取用生石灰时,发现装满生石灰的瓶已膨胀爆裂(如图1)。化学兴趣小组对这瓶生石灰进行了如下探究:
(查阅资料):①氢氧化钙微溶于水(20℃时,100克水中最多溶解0.165克氢氧化钙)②氢氧化钙水溶液可以使无色酚酞溶液变红色。
(1)探究一:该生石灰是否变质?
(2)探究二:生石灰变质后的成分是什么?
实验操作 | 现象 | 结论和解释 |
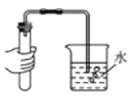
取生石灰样品少许放入烧杯中加水搅拌插入温度计(如图2) | 形成浊液,温度___(升高、降低或不变) | 结论:生石灰已变质,解释:___。 |
猜想与假设:①氢氧化钙;②碳酸钙;③氢氧化钙和碳酸钙。
实验操作 | 现象 | 结论和解释 |
取生石灰样品少许放入烧杯中加水搅拌,过滤,向滤液中滴加酚酞溶液,向滤渣滴加足量的___(填试剂名称)。 | 滤液变___色;滤渣上产生大量气泡。 | 结论:猜想③正确。解释:生石灰变质过程中产生碳酸钙的化学方程式是___ |
(3)探究三:变质的生石灰中碳酸钙的质量分数是多少?
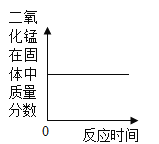
方案一:取10.0g样品加100克水搅拌溶解过滤将固体干燥后称量为9.8g,计算得到碳酸钙的质量分数为98.0%.方案一是否合理?___理由是___。
方案二:取10.0g样品,请设计完成方案二,同时说明要测定的量(用a表示),并计算样品中碳酸钙的质量分数。___(不要求写出计算过程)。
【答案】不变 生石灰和水反应生成氢氧化钙,放热 稀盐酸 红色 Ca(OH)2+CO2═CaCO3↓+H2O 不合理 理由是氢氧化钙微溶于水,滤渣中可能含有没有溶解的氢氧化钙 取10.0g样品,加入足量稀盐酸,把产生的气体通入足量氢氧化钠溶液中,测定氢氧化钠溶液增加的质量a,![]()
【解析】
(2)取生石灰样品少许放入烧杯中加水搅拌插入温度计,形成浊液,温度不变,说明生石灰已经完全变质,实验过程如下所示:
实验操作 | 现象 | 结论和解释 |
取生石灰样品少许放入烧杯中加水搅拌插入温度计 | 形成浊液,温度不变 | 结论:生石灰已变质 解释:生石灰和水反应生成氢氧化钙,放热。 |
取生石灰样品少许放入烧杯中加水搅拌,过滤,向滤液中滴加酚酞溶液,向滤渣滴加足量的稀盐酸,滤液变红色,说明含有氢氧化钙,滤渣上产生大量气泡,是因为碳酸钙和盐酸反应生成了二氧化碳,说明含有碳酸钙,氧化钙和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,氢氧化钙和二氧化碳反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O,实验过程如下所示:
实验操作 | 现象 | 结论和解释 |
取生石灰样品少许放入烧杯中加水搅拌,过滤,向滤液中滴加酚酞溶液,向滤渣滴加足量 的稀盐酸。 | 滤液变红色; 滤渣上产生大量气泡。 | 结论:猜想③正确。 解释:生石灰变质过 程中产生碳酸钙的化 学方程式是:Ca(OH)2+CO2═CaCO3↓+H2O |
(3)方案一不合理,理由是氢氧化钙微溶于水,滤渣中可能含有没有溶解的氢氧化钙。
取10.0g样品,加入足量稀盐酸,把产生的气体通入足量氢氧化钠溶液中,测定氢氧化钠溶液增加的质量a;
由题意可知增加的质量a即为反应生成的二氧化碳的质量,设碳酸钙质量为x,
 ,
,
![]()
x=![]() ,
,
碳酸钙质量分数为:![]() ×100%=
×100%=![]() ,
,
故填取10.0g样品,加入足量稀盐酸,把产生的气体通入足量氢氧化钠溶液中,测定氢氧化钠溶液增加的质量a,碳酸钙质量分数为![]()

【题目】小金在学习了酸的性质后,对家中放置的草酸十分感兴趣,决定探究草酸晶体的化学性质。他先上网查寻,得知草酸(H2C2O42H2O)是一种无色晶体,熔点为101℃,易熔化成液体,受热易分解,分解时会有CO产生,接着他对受热分解的产物进行了进一步实验探究。
(1)猜想分解的产物
猜想一:CO、H2O
猜想二:CO2、CO
猜想三:CO2、CO和H2O
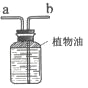
(2)小金设计了如图装置。在A框中,小金选择乙作为晶体受热分解的发生装置,为什么不选择甲呢?请说明理由______;
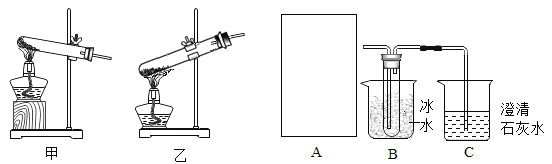
(3)假设每步反应都完全反应,实验操作及数据如表:
步骤 | 操作 | 质量/g |
1 | 称量草酸晶体的质量 | m1 |
2 | 加热草酸晶体 | / |
3 | 冷却 | / |
4 | 称量装置B中试管质量增重 | m2 |
5 | 称量C烧杯增重 | m3 |
(4)由上述实验判断,猜想三是正确的,支持该猜想的证据是______,且m1:m2:m3=______。
(5)从实验室安全角度考虑,图示装置还应采取的改进措施是______。