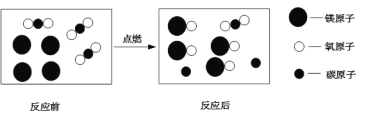
题目内容
【题目】为测定某石灰石样品中碳酸钙的质量分数,某化学兴趣小组的同学进行了实验探究,取12.5g的石灰石样品放入烧杯中,加入稀盐酸至不再产生气泡为止(假设杂质不溶于水,也不和颜色反应),其反应的情况如图所示,请计算:
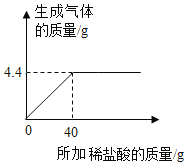
(1)12.5g石灰石样品中碳酸钙的质量为______;
(2)所用稀盐酸的溶质的质量分数是多少_____?(要求根据化学方程式进行计算)
【答案】10g 18.25%
【解析】
(1)由图象可知,生成二氧化碳的质量为4.4g。
设碳酸钙的质量为x,盐酸中溶质的质量y。
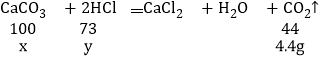
x=10g
y=7.3g
(2)稀盐酸的溶质的质量分数是:![]() ×100%=18.25%
×100%=18.25%
答:(1)石灰石样品中碳酸钙的质量为10g;(2)所用稀盐酸的溶质的质量分数是18.25%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】小金在学习了酸的性质后,对家中放置的草酸十分感兴趣,决定探究草酸晶体的化学性质。他先上网查寻,得知草酸(H2C2O42H2O)是一种无色晶体,熔点为101℃,易熔化成液体,受热易分解,分解时会有CO产生,接着他对受热分解的产物进行了进一步实验探究。
(1)猜想分解的产物
猜想一:CO、H2O
猜想二:CO2、CO
猜想三:CO2、CO和H2O
(2)小金设计了如图装置。在A框中,小金选择乙作为晶体受热分解的发生装置,为什么不选择甲呢?请说明理由______;
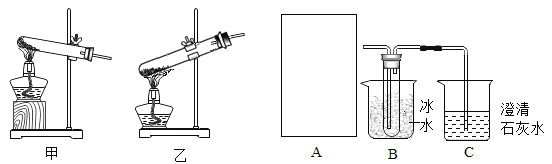
(3)假设每步反应都完全反应,实验操作及数据如表:
步骤 | 操作 | 质量/g |
1 | 称量草酸晶体的质量 | m1 |
2 | 加热草酸晶体 | / |
3 | 冷却 | / |
4 | 称量装置B中试管质量增重 | m2 |
5 | 称量C烧杯增重 | m3 |
(4)由上述实验判断,猜想三是正确的,支持该猜想的证据是______,且m1:m2:m3=______。
(5)从实验室安全角度考虑,图示装置还应采取的改进措施是______。
【题目】下图是实验室制备气体的部分装置。
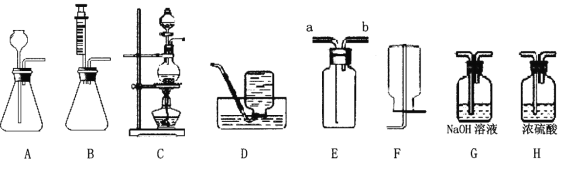
(1)上图装置可以制取不同气体,请完成下表空格。
反应物和反应条件 | 制取的气体 | 发生装置(填字母) | 收集装置(填字母) |
H2O2溶液和MnO2固体,常温 | ______ | A或B | 或E |
亚硫酸钠(Na2SO3)固体和浓硫酸,常温 | SO2 | ______ | E |
甲酸( HCOOH)和浓硫酸,加热 | CO | ______ | D |
(2)用A装置制取O2时,反应的化学方程式为____________________,若要得到干燥的O2,所选择装置的连接顺序为:A→____→ _____ (填字母序号)。
(3)用E装置收集SO2时,气体应由(填“a”或“b”)________端进入。