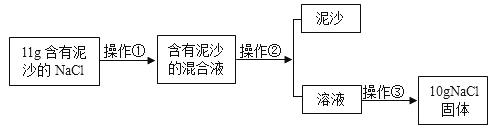
题目内容
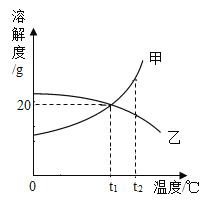
【题目】如图是甲、乙两种物质的溶解度曲线。将t2°C时甲、乙的饱和溶液降温到t1°C,所得溶液中甲、乙的溶质质量分数是甲___________乙(填“大于”“小于”或“等于”)。将乙的饱和溶液变为不饱和溶液,可采用的方法是___________;t1°C时,将120g甲的饱和溶液稀释成溶质质量分数10%的溶液,需加水__________g。
【答案】大于 增加溶剂(或降低温度) 80
【解析】
解:饱和溶液中溶质的质量分数=![]() 。甲的溶解度随温度的升高而增大,乙的溶解度随温度的升高而减小,将t2°C时甲、乙的饱和溶液降温到t1°C,甲溶液中有晶体析出,乙溶液中无明显现象,且乙溶液变为不饱和溶液,乙溶液的溶质质量分数和t2°C时相等,甲溶液的溶质质量分数减小。由于t1°C时甲的溶解度大于t2°C时乙的溶解度,因此降温后甲的溶质质量分数大于乙。将乙的饱和溶液变为不饱和溶液,应采用增加溶剂或降低温度的方法;设:需加水的质量为x,则有
。甲的溶解度随温度的升高而增大,乙的溶解度随温度的升高而减小,将t2°C时甲、乙的饱和溶液降温到t1°C,甲溶液中有晶体析出,乙溶液中无明显现象,且乙溶液变为不饱和溶液,乙溶液的溶质质量分数和t2°C时相等,甲溶液的溶质质量分数减小。由于t1°C时甲的溶解度大于t2°C时乙的溶解度,因此降温后甲的溶质质量分数大于乙。将乙的饱和溶液变为不饱和溶液,应采用增加溶剂或降低温度的方法;设:需加水的质量为x,则有![]() ,求得x=80 g。
,求得x=80 g。

【题目】小彬同学家新买了水龙头,从说明书上了解到该水龙头是铜质镀铬的。他想起在学习金属性质时用到的金属活动性顺序中没有铬,为了解铬与铝、铜的金属活动性相对强弱关系,进行如下探究活动:
(查阅资料)
(1)铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜。
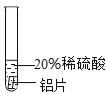
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
(3)铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液。
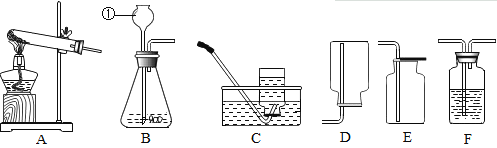
(实验过程)取大小相同的三种金属薄片,用砂纸打磨光亮。
实验一 | 实验二 | 实验三 | |
实验方案 |
|
|
|
实验现象 | 铬片表面产生气泡缓慢,溶液变蓝色。 | a | 铝片表面产生气泡较快。 |
结论 | 铬能和稀硫酸发生反应,反应速率较慢。 | 铜不与稀硫酸反应 | b |
三种金属的金属活动性由强到弱的顺序是:c | |||
(回答问题)
(1)上表空白处,请填写合适内容:a_____ b_____ c_____
(2)用砂纸打磨金属片的目的是:_____。
(3)实验一中,发生反应的化学方程式是:_____。
(4)小东提出,用硫酸铜溶液代替上述实验中的稀硫酸,也能得出三种金属的相对强弱关系。小燕认为不可行,理由是_____。
(5)小清认为,只要选用三种试剂或药品,两两反应进行实验,就可以比较得出三种金属的强弱关系,这三种药品可以是_____ (写出一组即可)。