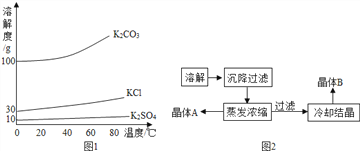
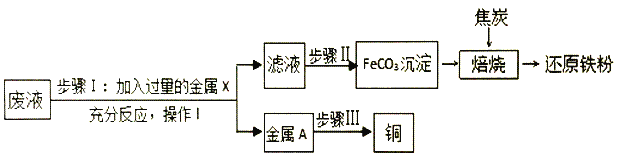
题目内容
【题目】现有氧化镁、氢氧化镁和氯化镁的混合物 24g,加入 100g 7.3%的稀盐酸恰好完全反应,反应结束后蒸发,所得氯化镁的质量可能是
A. 26g B. 28g C. 30g D. 32g
【答案】B
【解析】氧化镁、氢氧化镁与盐酸反应后都生成氯化镁,反应前后氯离子的质量不变,氯化氢的质量为:100g×7.3%=7.3g,氯离子的质量为:7.3g×![]() ×100%=7.1g;设生成氯化镁的质量为x,则有:x×
×100%=7.1g;设生成氯化镁的质量为x,则有:x×![]() ×100%=7.1g,x=9.2g。
×100%=7.1g,x=9.2g。
当与稀盐酸反应的全部是氧化镁时,设氧化镁的质量为m,则有:
MgO~MgCl2
40 95
m 9.5g
![]()
m=4.0g
故混合物中氯化镁的质量为:24g-4g=20g;所得氯化镁的质量:20g+9.2g=29.2g;
当与稀盐酸反应的全部是氢氧化镁时,设氢氧化镁的质量为n,则有:
Mg(OH)2~MgCl2
58 95
n 9.5g
![]()
m=5.8g
故混合物中氯化镁的质量为:24g-5.8g=18.2g;所得氯化镁的质量:18.2g+9.2g=27.4g;
因为混合物24g是氧化镁、氢氧化镁和硫酸镁的混合物,故所得氯化镁的质量在27.4g~29.2g之间。故选B。

【题目】过碳酸钠(化学式为2Na2CO33H2O2)俗名固体双氧水。溶于水可看作是Na2CO3溶液和H2O2溶液混合。为了方便保存,过碳酸钠样品可能添加少量的MgSO4和硅酸镁中的一种或二种作为稳定剂。已知①双氧水可用于供氧、消毒和漂白;②硅酸镁不溶于水。
(1)过碳酸钠的用途不合理的是 。
A.鱼池供氧剂 B.消毒剂 C.干燥剂 D.漂白剂
(2)取少量过碳酸钠样品于烧杯中,加入足量蒸馏水,有不溶于水的固体产生。判断样品中 有硅酸镁。(填写“可能”或“一定”)
(3)利用实验室限选试剂,设计实验确定该样品中是否添加少量的MgSO4。
限选试剂:稀盐酸、稀H2SO4、BaCl2溶液、蒸馏水、AgN03溶液
实验操作 | 预期现象和必要结论 |
步骤:1:取少量样品于烧杯中,缓慢加入足量蒸馏水,充分搅拌,静置,过滤。 |
|
步骤2:取少量步骤1所得的滤液于试管中,加入 ,振荡后静置。 | |
步骤3:取少量步骤2所得的溶液于试管中, 。 | ,说明样品中有MgSO4。 ,说明样品中没有MgSO4。 |
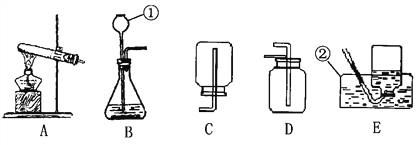
【题目】根据下列装置,结合所学化学知识回答下列问题:
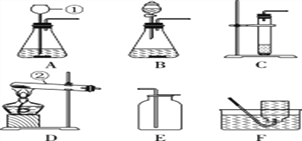
(1) 写出图中标号仪器的名称:① _______。
(2) 实验室用高锰酸钾制取氧气时,发生装置应选用________(填字母);其反应的化学方程式为__________________________。如果改用氯酸钾和二氧化锰制取氧气,反应前后二氧化锰的质量分数________(填“增大”、“减小”或“不变”)。
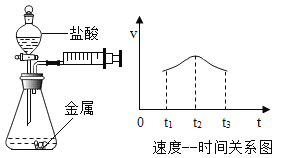
(3) 实验室制取少量二氧化碳时,发生装置最好选用________(填字母,下同),收集装置选用________,常用此收集方法的原因是____________________,某同学取一定浓度盐酸与石灰石反应,将生成的气体通入澄清石灰水中,始终未见浑浊,可能的原因______________________________________________
(4) 化学反应可控制才能更好地为人类造福,我们可以通过改变反应的条件、药品用量、改进装置等途径来达到控制反应的目的。常温下块状电石(CaC2)与水反应生成乙炔(C2H2)气体和氢氧化钙,该反应的化学方程式是______________________________,实验室制取乙炔时,须严格控制加水速度,以免剧烈反应放热引起装置炸裂。图中适合制取乙炔气体的发生装置有________(填装置序号)。
(5)下图是干燥、收集某气体的装置。由实验装置可以推测该气体的有关性质,请你在表中找出相对应的选项(____)
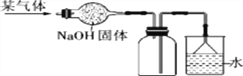
序号 气体性质 | A | B | C | D |
溶于水中所得溶液的pH | >7 | <7 | >7 | <7 |
其密度(ρ1)与空气密度(ρ2)的比较 | ρ1>ρ2 | ρ1>ρ2 | ρ1<ρ2 | ρ1<ρ2 |
在水中的溶解性 | 极易溶 | 难 溶 | 极易溶 | 难 溶 |