题目内容
【题目】某化工厂排放的废水中含有碳酸钾和氢氧化钾,化学兴趣小组为探究废水中碳酸钾的含量,提取50g废水样品于集气瓶中,逐滴加入9.8%的稀硫酸,反应过程中产生二氧化碳的质量与加入稀硫酸的质量如下图,请计算。
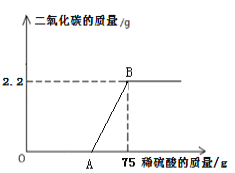
(1)生成二氧化碳的质量为 g;
(2)该废水中碳酸钾的质量分数(写出计算过程);
(3)反应后生成硫酸钾的质量为 g。
【答案】(1)2.2(2分)
(2)解:设废水中碳酸钾的质量分数为x.
K2CO3+H2SO4===K2SO4+H2O+CO2↑
138 44
50g×x 2.2g
138:44==50g×x:2.2g
x===13.8%
答:废水中碳酸钾的质量分数为13.8%。
(3)13.05(2分)
【解析】
试题分析:该题中涉及的反应为K2CO3+H2SO4===K2SO4+H2O+CO2↑ 和2KOH+H2SO4===K2SO4+2H2O;已知数据为废水样品50g和9.8%的稀硫酸发生反应的为75g。
(1)由图可知;
(2)如果碳酸钾的质量分数设为x,那么参与K2CO3+H2SO4===K2SO4+H2O+CO2↑中的K2CO3的质量为50g×x,再根据方程式来列出质量比等式求得;
(3)由反应方程式结合质量守恒定律,硫酸钾中的硫酸根的质量=参与反应的硫酸中硫酸根。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】下表记录了物质X的溶液分别加入到另外三种物质的溶液中产生的现象。则物质X的化学式可能是
氢氧化钠 | 碳酸钠 | 石蕊 | |
物质X | 无明显现象 | 产生气泡 | 溶液变红 |
A.Ca(OH)2 B.CuSO4
C.HCl D.NaCl