题目内容
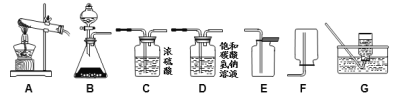
【题目】下图为实验室中常见的气体制备、净化、收集和性质实验的部分仪器。
根据题目要求,请回答下列问题:
(1)甲组同学以石灰石和稀盐酸为原料,欲在实验室中制备并收集一瓶纯净干燥的二氧化碳气体。他们按照要求设计实验装置、连接仪器,并检验了装置的气密性。(提示:盐酸挥发出的少量HCl气体杂质可用饱和碳酸氢钠溶液去除)
①他们所选仪器的连接顺序应为(填写仪器序号字母)_______。
②用石灰石和稀盐酸制取二氧化碳的反应方程式为____。
③装置B也可用于实验室法制取氧气,用过氧化氢溶液和二氧化锰制取氧气的化学方程式为____。
(2)乙组同学在实验结束回收药品时,不小心将两瓶标签不慎脱落的黑色粉末混合,已知在探究实验过程中用到的黑色粉末有两种:铁粉和氧化铜粉末。现在欲通过实验来确定该瓶混合后的黑色粉末的组成。
小路同学设计了如图所示的实验装置,并进行了如下实验探究:
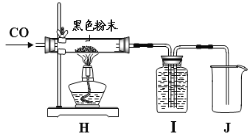
用电子秤称取8.0 g黑色粉末样品放入装置H中硬质玻璃管内,先通入一氧化碳一段时间,再用酒精灯加热;充分反应后,先停止加热,再继续通入一氧化碳到装置冷却至室温时为止。(已知:在加热条件下,一氧化碳能与氧化铜发生氧化还原反应,生成单质铜和二氧化碳)
①装置H中可能发生的反应方程式为____。
②为了检验气体生成物,同时收集尾气一氧化碳,装置I中盛放的试剂应为___(填序号)。
A 水 B 紫色石蕊试液 C 澄清石灰水 D 氢氧化钠溶液
③反应结束后,小路同学测得硬质玻璃管内剩余固体的质量为m ,请你帮她进行数据分析,并完成下表中的相关填空:
实验组号 | 数据收集 | 实 验 结 论 |
Ⅰ | 若m = 8.0g | 该样品全部是Fe粉。 |
Ⅱ | 若m =7.2g | CuO与Fe粉的质量比为______ |
Ⅲ | 若m =__g | 该样品全部是CuO粉末。 |
【答案】B→D→C→E ![]()
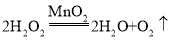
![]() C 1 : 1 6.4
C 1 : 1 6.4
【解析】
(1)以石灰石和稀盐酸为原料,制备并收集一瓶纯净干燥的二氧化碳气体,该反应属于固液混合不需加热型,发生装置为B,先用饱和碳酸氢钠溶液去除盐酸挥发出的少量HCl气体杂质,然后通过浓硫酸干燥,二氧化碳密度比空气大、能溶于水,用向上排空法收集;
①他们所选仪器的连接顺序应为B→D→C→E。
②用石灰石和稀盐酸制取二氧化碳,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,反应方程式为![]() 。
。
③装置B也可用于实验室法制取氧气,用过氧化氢溶液和二氧化锰制取氧气,二氧化锰催化过氧化氢反应生成水和氧气,反应的化学方程式为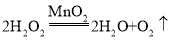 。
。
(2)黑色粉末有两种:铁粉和氧化铜粉末;
①装置H中可能发生的反应为氧化铜与一氧化碳在加热条件下反应生成铜和二氧化碳,反应的方程式为![]() 。
。
②为了检验气体生成物二氧化碳,二氧化碳能使澄清石灰水变浑浊,装置I中盛放的试剂应为澄清石灰水;
故填:C。
③反应结束后,测得硬质玻璃管内剩余固体的质量为m:
Ⅰ、若m=8.0g,即样品不与一氧化碳反应,则该样品全部是Fe粉;
Ⅱ、若m =7.2g,设样品中CuO的质量为x,则
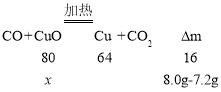
![]()
x=4.0g;
则样品中铁的质量为8.0g-4.0g=4.0g,CuO与Fe粉的质量比为1:1;
Ⅲ、若该样品全部是CuO粉末,设固体减少的质量为y,则
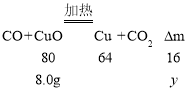
![]()
y=1.6g;
则m=8.0g-1.6g=6.4g;
故有:
实验组号 | 数据收集 | 实 验 结 论 |
Ⅰ | 若m = 8.0g | 该样品全部是Fe粉。 |
Ⅱ | 若m =7.2g | CuO与Fe粉的质量比为1:1 |
Ⅲ | 若m =6.4g | 该样品全部是CuO粉末。 |