题目内容
【题目】某学校兴趣小组在参与“五水共治”行动中,考察了某工厂的废水处理工程,并取该厂未经处理的废水样品进行测定分析:
(1)用紫色石蕊试液检验废水的酸碱性,石蕊试液呈 色,说明该废水显酸性。
(2)另取废水样品少量,滴加适量Ba(NO3)2,有白色沉淀产生,说明该废水中一定含有的酸根离子是 。
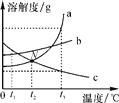
(3)同学们进一步了解到该废水中中含有一种酸,为测定其所含酸的质量分数,取该废水200克于烧杯中,逐渐加入硝酸钡溶液,生成的沉淀质量与加入硝酸钡溶液的质量关系如图所示,请计算废水中硫酸的质量分数。(假设该废水中的其他物质均溶于水且不与硝酸钡溶液反应)

【答案】(1)红 (2)硫酸根离子 (3)废水中硫酸的质量分数为4.9%
【解析】
试题分析:
(1)用紫色石蕊试液检验废水的酸碱性,石蕊试液呈红色,说明该废水显酸性;
(2)另取废水样品少量,滴加适量Ba(NO3)2,有白色沉淀产生,说明该废水中一定含有的酸根离子是硫酸根离子;
(3)根据图示可知:当消耗稀硫酸为100g时,恰好完全反应,生成沉淀的质量为23.3g
设废水中硫酸的质量为x
H2SO4+Ba(NO3)2=BaSO4↓+2HNO3
98 233
x 23.3g
![]()
x=9.8g
废水中硫酸的质量分数=![]() 100%=4.9%。
100%=4.9%。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目