题目内容
【题目】小明同学旅游到山区,看到清澈的泉水,引起了他思考。
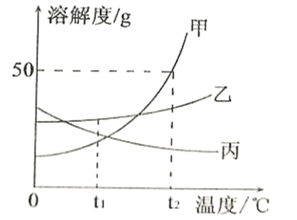
(1)这清澈的泉水是硬水还是软水,可用来检测软硬水的物质是_____。写出水中硝酸根离子的化学符号_____,硫酸钙的化学式_____。
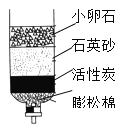
(2)有些村民取泉水时不断搅动,使水变浑浊了,小明用如图方法进行净化,其中小卵石、石英砂的作用是_____。
(3)如果地下水硬度大,或者水中病原微生物过多,都可以采用_____方法来降低硬度和杀灭病原微生物。
(4)从微粒的角度分析,压缩冷凝时空气中的水蒸气变为液态水,变化的是_____。
【答案】肥皂水 NO3- CaSO4 过滤 煮沸 分子间的间隔变小了
【解析】
(1)区分硬水和软水的方法是:用肥皂水,加入肥皂水,泡沫多的是软水,泡沫少的是硬水;
离子的表示方法:在该离子元素符号的右上角标上该离子所带的正负电荷数,数字在前,正负号在后,带一个电荷时,1通常省略,多个离子,就是在元素符号前面加上相应的数字;故硝酸根离子的化学符号为![]() ;硫酸钙中钙元素显+2价,硫酸根显-2价,硫酸钙的化学式为CaSO4。
;硫酸钙中钙元素显+2价,硫酸根显-2价,硫酸钙的化学式为CaSO4。
故填:肥皂水;NO3-;CaSO4。
(2)用如图方法进行水的净化,其中小卵石、石英砂的作用是过滤。
故填:过滤。
(3)如果地下水硬度大,或者水中病原微生物过多,都可以采用煮沸方法来降低硬度和杀灭病原微生物。
故填:煮沸。
(4)压缩冷凝时空气中的水蒸气变为液态水属于物理变化,变化的是分子间隔,分子间的间隔变小了。
故填:分子间的间隔变小了。

 阅读快车系列答案
阅读快车系列答案【题目】取20g碳酸钠和碳酸氢钠的固体混合物,加热至不再产生气体2NaHCO3![]() Na2CO3+H2O+CO2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
Na2CO3+H2O+CO2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
时间 | 0分钟 | 1分钟 | 2分钟 | 3分钟 |
仪器和浓硫酸的质量总和(g) | 150 | 150.9 | 151.8 | 151.8 |
(1)当完全反应后,生成水的质量为_____g。
(2)计算混合物中碳酸氢钠的质量分数________。(要求写出计算过程)
(3)将上述混合物完全分解后的固体溶解于186.2g 水中,待固体完全溶解后所得溶液中溶质的质量分数为_____。
【题目】小金为探究铁制品锈蚀的条件,进行如下实验:
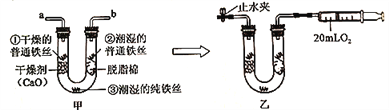
步骤1:利用图甲所示装置,将干燥的O2从导管a通入U形管(装置气密性良好.药品如图所示);待U形管内充满O2后,在导管b处连接一活塞推至底部的注射器,收集20mLO2后在导管a处连接乳胶管并用止水夹夹紧,如图乙所示。
步骤2:一段时间后,观察U形普内的铁丝其现象如表所示。
观察对象 | 现象 |
①干燥的普通铁丝 | 没有明显变化 |
②潮湿的普通铁丝 | 较多红褐色锈斑 |
③潮湿的纯铁丝 | 没有明显变化 |
(1)步骤1中,检查U形管内是否已充满O2的方法是_______。
(2)铁制品锈蚀的条件之一是需要 O2,在此实验中能支持此条件的证据是_____。
(3)通过对比实险现象,此实验还可得出铁制品锈蚀的条件是________。
【题目】为测定某氧化铜和铜的固体混合物中氧化铜的质量分数,小勇同学取20g固体混合物置于烧杯中,将100g稀硫酸分为四等份依次加入其中进行实验,测得数据如下:
次序 | ① | ② | ③ | ④ |
加入稀硫酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 16 | a | 10 | 10 |
回答下列问题:
(1)原固体混合物中,氧化铜的质量分数为_____。
(2)上表中,a的值为_____。
(3)计算该实验所用稀硫酸中溶质的质量分数。_____(写出计算过程,结果精确到0.1%)