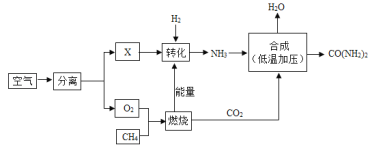
题目内容
【题目】为测定某氧化铜和铜的固体混合物中氧化铜的质量分数,小勇同学取20g固体混合物置于烧杯中,将100g稀硫酸分为四等份依次加入其中进行实验,测得数据如下:
次序 | ① | ② | ③ | ④ |
加入稀硫酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 16 | a | 10 | 10 |
回答下列问题:
(1)原固体混合物中,氧化铜的质量分数为_____。
(2)上表中,a的值为_____。
(3)计算该实验所用稀硫酸中溶质的质量分数。_____(写出计算过程,结果精确到0.1%)
【答案】50% 12 19,6%(计算过程见解析)
【解析】
(1)根据第一次固体减少4g,而第三次后质量不变,说明第二次也减少4g,所以a=12,第三次氧化铜完全反应,剩余的10g为铜单质,所以氧化铜的质量为10g,原固体混合物中,氧化铜的质量分数为![]() ;
;
(2)分析表格数据可知,每加入25g稀硫酸可以反应4g氧化铜,故第②次实验中再加入25g稀硫酸又反应掉4g氧化铜,剩余固体质量为12g,即a的值为12;
(3)每25g稀硫酸与4g氧化铜完全反应
设该实验所用稀硫酸中溶质的质量分数为x
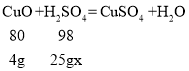
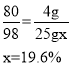
答:该实验所用稀硫酸中溶质的质量分数为19.6%。
故答案为:
(1)50%;
(2)12;
(3)19.6%。

练习册系列答案
相关题目
【题目】在宏观、微观和符号之间建立联系是化学学科的特点。甲和乙反应生成丙和丁的化学方程式用下列微观示意图表示:
物质 | 甲 | 乙 | 丙 | 丁 |
|
微观 示意图 |
| ||||
①请写出丙物质的化学式_____;下列属于丁物质的微观示意图的是_____。

②能保持甲化学性质的微粒是_____(填“分子”或“原子”),四种物质中属于氧化物的有_____(填甲、乙、丙、丁)。
③从上述反应重能获得的信息有_____(填一条即可)。
④上述微观示意图表示的化学方程式是:_____。