题目内容
【题目】已知烧杯中装有200g硫酸和硫酸铜混合溶液,其中含硫酸铜4.8g。向烧杯中逐渐加入氧化铜,烧杯中溶液的质量与加入氧化铜的质量关系如图所示。当恰好完全反应时,所得的溶液为不饱和溶液。

(提示:CuO + H2SO4 = CuSO4 + H2O)请计算:
(1)m=__________g。(1分)
(2)原混合溶液中H2SO4的质量分数。(2分)
(3)若取恰好完全反应时所得溶液10g配制成20%的硫酸铜溶液,需要30%的硫酸铜溶液多少克?(3分)
【答案】(1)8(2)4.9%(3)
【解析】
试题分析:(1)根据图示知,m为8克;(2)根据氧化铜质量,利用化学方程式进行计算,得出硫酸溶质质量,再用溶质质量除以混合物溶液质量。(3)根据溶液稀释前后,溶质质量保持不变进行计算。
具体如下:
解:设硫酸质量为X,生成硫酸铜质量为Y,需要30%的硫酸铜溶液质量为M
CuO+H2SO4==CuSO4+H2O
80 98 160
8克 X Y
80/98=8克/X X=9.8克 80/160=8克/Y Y=16克
所以原混合溶液中硫酸的质量分数=9.8/200克 ×100%=4.9%
反应后所得硫酸铜溶液中溶质质量= 4.8g+16g=20.8g

 名校课堂系列答案
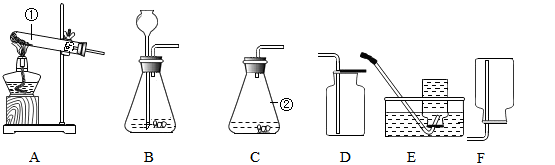
名校课堂系列答案【题目】(7分)FeCl3溶液能对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.
写出本实验发生反应的化学方程式 .
Ⅰ.分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCl3溶液,如图观察到 ,就可以粗略判断,得出实验结果.

为进一步判断上述实验结论的准确性,运用图,小刚同学进行了如下实验方案设计.
Ⅱ.
[方案一]在不同过氧化氢浓度下,测定收集相同气体体积所需时间.
[方案二]在不同过氧化氢浓度下,测定 ;
方案二的实验测量结果:
| 30% H2O2溶液的体积(mL) | 2% FeCl3溶液的体积(mL) | 加入H2O的体积(mL) | 反应的时间(min) | 生成O2的体积(mL) |
1 | 5 | x | 20 | 5 | V1 |
2 | 10 | 3 | 15 | y | V2 |
表中x= ,y= .
实验结论:通过测量,若V1 V2(填“>”、“=”或“<”),说明 .