题目内容
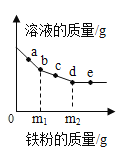
【题目】向装有过量锌粉的烧杯中加入一定质量AgNO3和Cu(NO3)2的混合溶液,烧杯中固体的质量随反应时间变化的情况如图所示。下列说法不正确的是()
A.t1时,向溶液中滴加氯化钠溶液,没有白色沉淀产生
B.t2和t3时,溶质种类不同,金属单质种类也不同
C.若向溶液中插入铝丝,铝丝表面有红色固体析出,则时间t的取值范围:t2﹤t﹤t4
D.t2时,溶液中的金属离子有Zn2+、Cu2+,固体中的金属单质有Zn、Ag
【答案】AB
【解析】
向装有过量锌粉的烧杯中加入一定质量AgNO3和Cu(NO3)2的混合溶液,锌先与硝酸银反应:![]() ,待硝酸银完全反应后,锌再与硝酸铜反应:
,待硝酸银完全反应后,锌再与硝酸铜反应:![]() 。
。
A、t1时,硝酸银未完全反应,向溶液中滴加氯化钠溶液,氯化钠与硝酸银反应生成氯化银和硝酸钠,有白色沉淀产生,符合题意;
B、t2时,硝酸银恰好完全反应,金属单质为银、锌,溶质为硝酸锌、硝酸铜,t3时,部分硝酸铜被置换,溶质为硝酸锌、硝酸铜,金属单质为银、铜、锌,故t2和t3时,溶质种类相同,金属单质种类不同,符合题意;
C、若向溶液中插入铝丝,铝丝表面有红色固体析出,说明硝酸银已经完全反应,因为溶液中若含有硝酸银,铝先与硝酸银反应,并且硝酸铜未完全反应,则时间t的取值范围:t2﹤t﹤t4,不符合题意;
D、t2时,硝酸银恰好完全反应,硝酸铜还未开始反应,锌与硝酸银反应生成硝酸锌和银,故溶液中的金属离子有Zn2+、Cu2+,固体中的金属单质有Zn、Ag,不符合题意。
故选AB。

【题目】小黎同学为了进一步加深对“碱的化学性质”的理解,特邀你协助完成下列活动与探究。
(1)如图所示,在白色点滴板上进行实验,请将实验现象填入下表:
氢氧化钠溶液 | 氢氧化钙溶液 | |
加紫色石蕊溶液 | ________________ | _____________ |
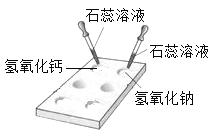
(2)回忆检验二氧化碳气体的反应,写出该反应的化学方程式:____________。二氧化硫与氢氧化钠溶液反应与上面的反应相似,写出这一反应的方程式:___________________。
(3)根据上面的实验和讨论,试归纳出氢氧化钠、氢氧化钙有哪些相似的化学性质。(任写两点)____________________,_____________________。
【题目】溶解度曲线的意义
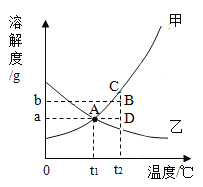
①表示溶解度随温度变化趋势:大多数物质溶解度随温度升高而增大如_____。少数物质溶解度随温度升高而变化不大如_____。极少数物质溶解度随温度升高而减小如_____。
②确定某温度下某物质的_____。
③交点表示两物质在该_____下溶解度_____。
④溶解度曲线上一点(如A点)表示t1℃甲物质的一种_____溶液,该溶液中溶质:溶剂:溶液(质量)=_____。
⑤溶解度曲线下一点(如B点)表示t2℃甲物质的一种_____溶液,该溶液中溶质:溶剂:溶液(质量)=_____。
⑥
实验操作 | A点溶液移动 | B点溶液移动 |
升温 | _____ | _____ |
降温 | _____ | _____ |
蒸发溶剂 | _____ | _____ |
加溶质 | _____ | _____ |
⑦50gB点甲物质溶液变为D点溶液最佳途径:_____。
【题目】稀土金属因其独特的性能而被誉为“新材料之母”。稀土金属钇的氧化物(Y2O3)广泛应用于航空航天涂层材料,其颗粒大小决定了产品的质量。利用富钇稀土(含Y2O3约70%,含Fe2O3、CuO、SiO2等约30%)生产大颗粒氧化钇的种工艺如下:
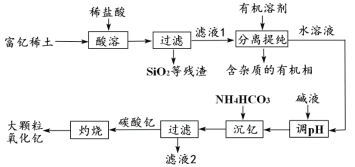
(1)氧化钇(Y2O3)中,Y元素的化合价为____________。
(2)“酸溶”过程中,氧化钇与盐酸反应的化学方程式是______________________________。
(3)“分离提纯”是为了除去滤液1中的_____________________________(填化学式)。
(4)“调pH”时加入碱液使溶液的pH_____________(填“增大”或“减小”)。
(5)碳酸钇灼烧分解的化学方程式是_______________________________________。
(6)为了获得大颗粒氧化钇,某小组研究了条件对产品直径的影响,相关数据如下(D50表示颗粒直径):
实验编号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
沉淀反应温度/℃ | 60 | 80 | 85 | 93 | 93 | 93 |
料液浓度Kg/L | 30 | 30 | 30 | 30 | 40 | 40 |
灼烧温度/℃ | 1100 | 1100 | 1100 | 1100 | 1100 | 1400 |
氧化钇D50/um | 6.00 | 21.65 | 35.99 | 38.56 | 35.99 | 61.54 |
分析上表数据,其他条件不变时,若将灼烧温度均升高至1400℃,预期所得氧化钇D50最大的是____________(填实验编号)。