题目内容
【题目】3000多年前,我国已经能用孔雀石[主要成分Cu(OH)2CO3]和木炭为原料炼铜。为了证实该历史的真实性,取含铜元素质量为2m的碱式碳酸铜和一定量的木炭粉进行加热,完全反应后得到红色固体(铜元素几乎完全转移到红色固体中)。
(提出问题)该红色固体的成分是什么?
(查阅资料)含铜元素的红色固体除了铜,还有氧化亚铜(Cu2O);Cu2O能与稀硫酸反应,其化学方程式为![]() ;CuSO4溶于水呈蓝色。
;CuSO4溶于水呈蓝色。
(猜想与假设)①红色固体是Cu;②红色固体是Cu2O;③红色固体是_____。
(实验方案)
实验操作 | 实验现象 | 实验结论 |
取实验所得红色固体的1/2于一支试管中,加入足量的稀硫酸 | ①_____ | ②_____ |
③_____ | ④_____ |
(反思)经分析,上述方案仍可能无法得出正确结论。请你从定量的角度进一步设计方案。你的方案是_____。
【答案】Cu和Cu2O 无明显现象 红色固体是Cu(或猜想①正确) 固体部分减少,溶液变为蓝色(答到溶液颜色变蓝即可) 红色固体是Cu2O或红色固体是Cu和Cu2O(猜想②或③正确) 方案:称量剩余红色固体,设其质量为x。若质量x=m,则为Cu;若质量x=9m/8,则为Cu2O;若质量m﹤x ﹤9m/8,则为Cu和Cu2O。(合理即可)
【解析】
猜想与假设:
①红色固体是Cu;②红色固体是Cu2O;③红色固体是Cu和Cu2O。
实验方案:
因为铜单质不和稀硫酸反应,Cu2O能与稀硫酸反应,其化学方程式为![]() ;CuSO4溶于水呈蓝色。取实验所得红色固体的1/2于一支试管中,加入足量的稀硫酸, 若无明显现象,则红色固体是Cu(或猜想①正确),若固体部分减少,溶液变为蓝色,红色固体是Cu2O或红色固体是Cu和Cu2O(猜想②或③正确)
;CuSO4溶于水呈蓝色。取实验所得红色固体的1/2于一支试管中,加入足量的稀硫酸, 若无明显现象,则红色固体是Cu(或猜想①正确),若固体部分减少,溶液变为蓝色,红色固体是Cu2O或红色固体是Cu和Cu2O(猜想②或③正确)
反思:
方案:称量剩余红色固体。
设剩余红色固体质量为x,因为题中实验方案中已用掉红色固体的1/2,还剩红色固体的1/2。根据碱式碳酸铜中铜元素总质量为2m,则剩余红色固体中铜元素质量为m。因此若剩余红色固体质量x=m,则为Cu;若剩余红色固体是Cu2O,可根据铜元素质量m,计算出Cu2O的质量为![]() 。计算过程如下:
。计算过程如下:
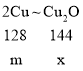
![]()
x=![]() 。
。
因此若剩余红色固体质量x=![]() ,则红色固体是Cu2O;若质量m﹤x ﹤
,则红色固体是Cu2O;若质量m﹤x ﹤![]() ,则红色固体为Cu和Cu2O。(合理即可)。
,则红色固体为Cu和Cu2O。(合理即可)。

【题目】长久使用的热水壶底部有一层水垢,主要成分是碳酸钙(CaCO3),某化学兴趣小组为了测定水垢中碳酸钙的质量分数,取25g水垢放入过量的稀盐酸的烧杯中,立即将烧杯放在天平上,称其质量。在以后的5min内,每一分钟读一次数。结果如下表,试回答下列问题:
时间/min | 0 | 2 | 3 | 4 | 5 |
质量/g | 100g | 95g | 92g | 91.2g | 91.2g |
(1)反应生成的二氧化碳的质量为多少?
(2)该水垢中CaCO3的质量分数为多少?