题目内容
【题目】长久使用的热水壶底部有一层水垢,主要成分是碳酸钙(CaCO3),某化学兴趣小组为了测定水垢中碳酸钙的质量分数,取25g水垢放入过量的稀盐酸的烧杯中,立即将烧杯放在天平上,称其质量。在以后的5min内,每一分钟读一次数。结果如下表,试回答下列问题:
时间/min | 0 | 2 | 3 | 4 | 5 |
质量/g | 100g | 95g | 92g | 91.2g | 91.2g |
(1)反应生成的二氧化碳的质量为多少?
(2)该水垢中CaCO3的质量分数为多少?
【答案】8.8g
80%
【解析】
(1)由表格中的数据可知,烧杯中的最终的质量为91.2g,故生成二氧化碳的质量为100g-91.2g=8.8g;
(2)设生成8.8g的二氧化碳需要碳酸钙的质量为x
CaCO3+2HCl == CaCl2+H2O+CO2↑
100 44
x 8.8g
![]() =
=![]() ,解得x=20g
,解得x=20g
该水垢中CaCO3的质量分数为![]() ×100%=80%
×100%=80%
答:反应生成的二氧化碳的质量为8.8g,该水垢中CaCO3的质量分数为80%。

【题目】在野外生存训练中可通过下图所示“钻木取火“的方法取得火种。同学们对用手快速转动取火棒就能使火引子产生火苗的现象提出质疑,并在实验室和老师一起展开如下探究。

(提出问题)燃烧的条件是什么?
(作出猜想)猜想一:燃烧需要可燃物
猜想二:燃烧需要可燃物和氧气
猜想三:__________
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
步骤一:分别在酒精灯火焰上同时加热片刻蘸有酒精和水的棉球。 | ________ | 猜想三正确 |
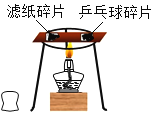
步骤二:将______的乒乓球片和滤纸片分别放在一块薄钢片的两侧,加热钢片中部,如下图所示。
| ___________ | |
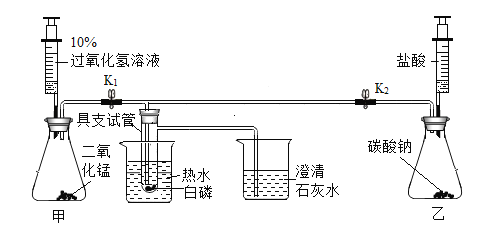
步骤三:在老师指导下,组装了以下装置。其操作方法是先关闭止水夹K1,打开止水央K2,将乙装置注射器中盐酸推入锥形瓶,再向烧杯中倒入80℃的热水,进行第一次观察现象。然后关闭止水央K2,打开止水央K1,将甲装置注射器中的过氧化氢溶液推入锥形瓶,进行第二次观察现象。
| 能说明可燃物燃烧需要氧气的现象是__________ |
(实验反思)
(1)步骤一中,若加热时间足够长,观察到的现象是________。
(2)“钻木取火”时适合做“火引子”的材料应具备的性能是_________。
(3)野外用火结束后,你认为应采取的灭火措施是___________。
【题目】3000多年前,我国已经能用孔雀石[主要成分Cu(OH)2CO3]和木炭为原料炼铜。为了证实该历史的真实性,取含铜元素质量为2m的碱式碳酸铜和一定量的木炭粉进行加热,完全反应后得到红色固体(铜元素几乎完全转移到红色固体中)。
(提出问题)该红色固体的成分是什么?
(查阅资料)含铜元素的红色固体除了铜,还有氧化亚铜(Cu2O);Cu2O能与稀硫酸反应,其化学方程式为![]() ;CuSO4溶于水呈蓝色。
;CuSO4溶于水呈蓝色。
(猜想与假设)①红色固体是Cu;②红色固体是Cu2O;③红色固体是_____。
(实验方案)
实验操作 | 实验现象 | 实验结论 |
取实验所得红色固体的1/2于一支试管中,加入足量的稀硫酸 | ①_____ | ②_____ |
③_____ | ④_____ |
(反思)经分析,上述方案仍可能无法得出正确结论。请你从定量的角度进一步设计方案。你的方案是_____。