题目内容
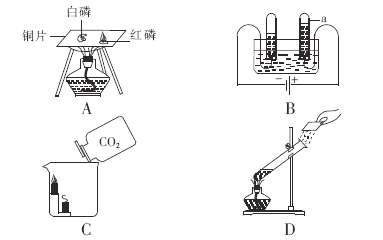
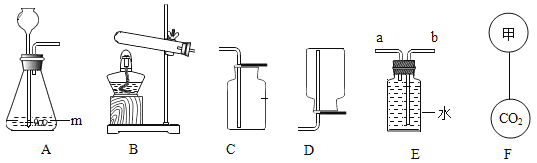
【题目】如图A为碳还原氧化铜的实验装置图。老师指出反应物不同的质量比可能会影响生成物的种类,在学习时,可以从定性观察和定量分析两个角度来判断生成物。请你跟随老师的思路,探究碳还原氧化铜生成的气体.(浓硫酸具有吸水性)
【提出问题】:碳还原氧化铜生成的气体是什么?
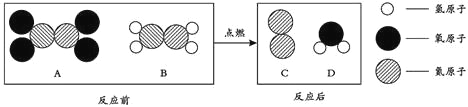
【作出猜想】:猜想①:CO 猜想②:CO2猜想③:__________
【实验设计】:装置图如图:
方案一:从定性观察角度判断:
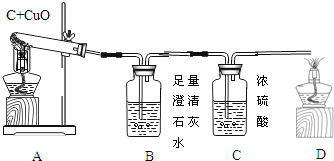
(1)若猜想3成立
Ⅰ、B处的现象是___________________
Ⅱ、D处发生反应的化学反应方程式___________________________
方案二:从定量计算角度判断:
测定表格中的四个数据:
反应前的质量 | 反应后的质量 | |
装置A | m1 | m2 |
装置B | m3 | m4 |
Ⅰ、若猜想②成立,则m4m3___m1m2(选填“>”、“<”或“=”),此时A中的现象是__________________,B发生反应的化学方程式为 _________________________
Ⅱ、实际测量中B增加的质量小于理论值,请你分析可能的原因__________________________
【答案】 CO和CO2 澄清石灰水变浑浊 2CO+O2![]() 2CO2 = 黑色粉末变红色
2CO2 = 黑色粉末变红色 ![]() 装置内会残留少量的CO2未被澄清石灰水吸收
装置内会残留少量的CO2未被澄清石灰水吸收
【解析】本题考查了碳与氧化铜在高温条件下反应产物成分的探究,解题时根据题中提供的猜想中物质性质进行分析,在实验数据处理时根据质量守恒定律进行分析。
【作出猜想】:猜想③:CO和CO2;
方案一:从定性观察角度判断:
(1)若猜想③成立,应有二氧化碳和一氧化碳生成;
Ⅰ、二氧化碳能使澄清的石灰水变浑浊,一氧化碳能燃烧,则B处澄清的石灰水变浑浊;
Ⅱ、一氧化碳燃烧时生成了二氧化碳,化学方程式为:2CO+O2点燃2CO2;
方案二:从定量计算角度判断:
Ⅰ、若猜想②成立,则反应生成的二氧化碳被B中的澄清石灰水吸收,生成的二氧化碳来自固体减少的质量,故m4﹣m3=m1﹣m2,A中碳和氧化铜高温反应生成铜和二氧化碳,此时A中的现象是黑色粉末变红色,B发生反应是二氧化碳与氢氧化钙反应生成碳酸钙和水,化学方程式为![]() ;
;
Ⅱ、实际测量中B增加的质量小于理论值,可能的原因是:装置内会残留少量的CO2未被澄清石灰水吸收。

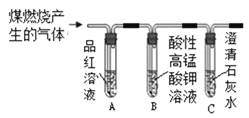
【题目】某小组同学利用比较方法对二氧化碳和二氧化硫的某些性质进行了初步探究。
【查阅资料】二氧化硫具有漂白性,其原因是二氧化硫与品红溶液等某些有色物质反应生成不稳定的无色物质,实验室常用红色的品红溶液检验二氧化硫的存在;二氧化硫可使酸性高锰酸钾溶液褪色,常用酸性高锰酸钾溶液除去二氧化碳中的二氧化硫。
【理论分析】(1)二氧化硫能引起酸雨,所以二氧化硫溶于水后,溶液显酸性。
(2)从物质分类角度,二氧化硫和二氧化碳都属于_________。
【设计与实验】
序号 | 操作 | 现象 | 分析与结论 |
1 | 用规格相同的两个软塑料瓶分别收集满二氧化硫和二氧化碳,然后加入等体积水(约占塑料瓶容积的三分之一)后,塞紧瓶塞振荡 | 两个塑料瓶都变瘪,且收集有二氧化硫的塑料瓶变得更瘪 | __________________ |
2 | 用两支试管分别取1中两个瓶中的液体,分别滴入紫色石蕊溶液, | ___________________ | 二氧化碳和二氧化硫溶于水所得溶液都显酸性 |
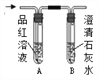
3 | 分别将二氧化碳和二氧化硫通入下列装置中
| 通过入二氧化碳时,A中无明显现象,B中_____________; 通入二氧化硫时,A中溶液由红色变成无色,B中液体变浑浊 | 二氧化硫可使品红溶液褪色,二氧化硫能使澄清石灰水变浑浊,通入二氧化碳后,B中反应的化学方程式为_______________ |
4 | 将3中通入二氧化硫后,试管A中无色液体加热 | 溶液又变成红色 | 溶液变成红色的原因是______________ |
【结论】二氧化碳和二氧化硫有一些相似的性质,但两者的性质不完全相同。
【拓展】小组同学设计如图所示装置,检验煤燃烧产物中既有二氧化碳,也有二氧化硫,实验中除可观察到B溶液变浅,但仍然有颜色外,还可观察到的现象有_________________。