题目内容
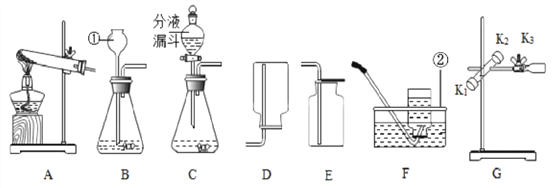
【题目】如图是实验室制取气体的有关装置图,据图回答下列问题:

(1)写出图中标号仪器的名称:m __________。
(2)若用大理石与稀盐酸反应制取CO2,则反应的化学方程式为__________________ 。收集装置为______ 。
(3)若用高锰酸钾制取氧气,选用的发生装置为______(填装置序号,下同),则反应的化学方程式为___________________________________ 。若用E装置收集氧气,氧气应从________(填“a”或“b”)端通入。
(4)若要F中的两个气球悬浮在空气中,则甲可能是________(填序号)。
a.空气 b.氧气 c.氢气
(5)兴趣小组探究了影响大理石与稀盐酸反应剧烈程度的因素.
【查阅资料】反应物的浓度越大,反应速率越快.
【实验过程】(注:盐酸足量)

【实验分析】
①若要探究盐酸浓度大小对反应的影响,可选择实验甲与____对照(选填实验编号)。
②除盐酸浓度大小外,上述实验研究的另两个影响反应的因素是___和______________。
【交流讨论】与甲比较,对丙的分析,错误的是__(选填编号)。
A、反应更为剧烈 B、产生的二氧化碳速度更快 C、产生的二氧化碳的质量更大
【答案】 锥形瓶 CaCO3+2HCl==CaCl2+H2O+CO2↑ C B 2KMnO4=K2MnO4+MnO2+O2↑, a c 丙 温度 反应物颗粒大小(反应物之间接触面积大小) C
【解析】(1)根据常见仪器解答;(2)根据碳酸钙与稀盐酸在常温下反应生成氯化钙、水和二氧化碳及二氧化碳密度比空气大解答;(3)根据高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气及氧气的密度比空气大解答;(4)根据二氧化碳的密度比空气大,则甲中气体的密度必须必空气小解答;(5)根据控制变量法分析解答。(1)图中标号为m仪器的名称是锥形瓶;(2) 碳酸钙与稀盐酸在常温下反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;收集装置为C;(3) 用高锰酸钾制取氧气,选用的发生装置为B,反应的化学方程式为2KMnO4△K2MnO4+MnO2+O2↑;氧气的密度比空气大,若用E装置收集氧气,氧气应从a端通入;(4) 若要F中的两个气球悬浮在空气中,由于二氧化碳的密度比空气大,则甲中气体的密度必须必空气小,则甲可能是氢气。故选c。(5) 【实验分析】①根据控制变量法可知,除盐酸浓度不同外,其余各量均应相同,因此可选择实验甲与丙对照;②根据控制变量法可知,除盐酸浓度大小外,上述实验研究的另两个影响反应的因素是温度和反应物颗粒大小(反应物之间接触面积大小);【交流讨论】与甲比较,丙中盐酸浓度比甲高,其余条件全部相同,故反应更为剧烈,产生的二氧化碳速度更快。而盐酸的质量与所用大理石的质量均相同,产生二氧化碳的质量相等。故选C。

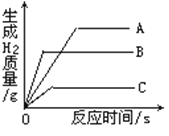
【题目】如图A为碳还原氧化铜的实验装置图。老师指出反应物不同的质量比可能会影响生成物的种类,在学习时,可以从定性观察和定量分析两个角度来判断生成物。请你跟随老师的思路,探究碳还原氧化铜生成的气体.(浓硫酸具有吸水性)
【提出问题】:碳还原氧化铜生成的气体是什么?
【作出猜想】:猜想①:CO 猜想②:CO2猜想③:__________
【实验设计】:装置图如图:
方案一:从定性观察角度判断:
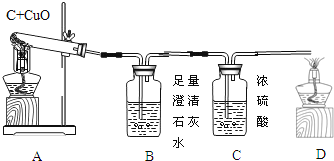
(1)若猜想3成立
Ⅰ、B处的现象是___________________
Ⅱ、D处发生反应的化学反应方程式___________________________
方案二:从定量计算角度判断:
测定表格中的四个数据:
反应前的质量 | 反应后的质量 | |
装置A | m1 | m2 |
装置B | m3 | m4 |
Ⅰ、若猜想②成立,则m4m3___m1m2(选填“>”、“<”或“=”),此时A中的现象是__________________,B发生反应的化学方程式为 _________________________
Ⅱ、实际测量中B增加的质量小于理论值,请你分析可能的原因__________________________
【题目】钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
I.铁的应用
(1)下列铁制品的利用与金属导热性有关的是_________________
A.铁钳 B.铁锅 C.刀具
(2)“纳米α-Fe粉”可以用于食品保鲜,称之为“双吸剂”,因为它能吸收空气中的_______。
II.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
(1)写出以赤铁矿为原料,在高温下炼铁的化学方程式:______________;
(2)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能____________。
Ⅲ.铁的活动性探究
现用一定量的AgNO3和Cu (NO3)2混合溶液,进行了如下图所示的实验,并对溶液A和固体B的成分进行了分析和研究.
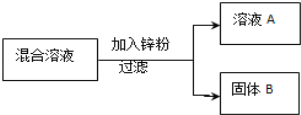
【提出问题】溶液A中的溶质可能有哪些?
【作出猜想】
①只有Zn(NO3)2
②有Zn(NO3)2、AgNO3
③有Zn(NO3)2、Cu(NO3)2
④有Zn(NO3)2、Cu(NO3)2、AgNO3
【交流讨论】不合理的猜想是_______(填标号),其理由是__________
【实验探究】根据如表中的实验步骤及现象,完成表中的实验结论
实验步骤 | 现象 | 实验结论 |
取少量固体B,滴加稀盐酸 | 有气泡产生 | 溶液A中的溶质成分符合猜想__, 固体B中的金属成分有________种. |
Ⅳ.生铁中铁含量的测定
某课外兴趣小组测定生铁(含杂质的铁,杂质既不溶于水也不溶于酸)中铁的质量分数,他们取五份样品,分别加稀硫酸反应.测得部分数据如下,请根据有关信息回答问题.
实验次数 | 1 | 2 | 3 | 4 | 5 |
取样品质量(g) | 30.0 | 30.0 | 30.0 | 30.0 | 30.0 |
取稀硫酸质量(g) | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
产生气体质量(g) | 0.2 | a | 0.6 | 0.8 | 0.9 |
(1)a的数值为_______________.
(2)第5次实验结束后,所得到溶液中溶质的化学式为_________________.
(3)列式计算该样品中单质铁的质量分数是______________。
(4)所用稀硫酸的溶质的质量分数为____________。