题目内容
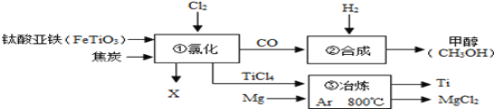
【题目】金属是现代生活和工业生产中应用极为普遍的一类材料。

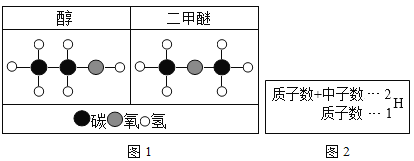
(1)青少年看书、写字一定要爱护眼睛,台灯在光线不足时常用照明用具。图1中灯管后面的反光片为铝箔铝块能制成铝箔利用了铝的________性;
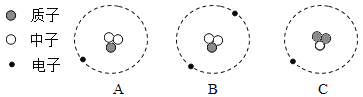
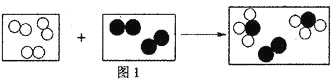
(2)Mg、Cu、Fe三种金属在稀盐酸里的反应现象如图2所示。图2中X所代表的金属是_______(填“Cu”或“Fe”);
(3)下列有关金属元素及其单质、化合物排列顺序正确的是___________;
AMn元素的化合价
B利用金属的年代:
C铜元素的质量分数
D元素的含量![]()
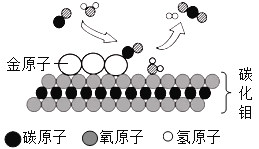
(4)金属的开发和利用是人类文明和社会进步的标志。美国普度大学研发出一种制备氢气的新工艺,流程如下图所示。

①此流程中,铝镓(Ga)合金________(填“可以”或“不可以”)循环使用;
②写出铝镓合金与水反应的化学方程式____________________。
(5)已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为证明Fe和Cu的存在并测定其中Al的质量分数,某化学兴趣小组的同学展开了如下的实验探究。
资料在线:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2Al+2H2O+2NaOH=2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应。
①请完成证明金属粉末中存在Fe和Cu的实验设计:
实验操作 | 实验现象 | 结论 |
I.取少量的金属粉末于试管中,加入足量的氢氧化钠溶液 | _______________________ | 仅除去铝 |
II.将试管静置,弃去上层清液,加入足量的_____________(填试剂名称)。 | __________________________________ | 证明含有铁 |
III.将试管静置,弃去上层清液,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
②为探究该金属粉末中Al的质量分数,取20 g该金属粉末,把100 g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量。实验过程中得到的部分数据与图象如下:

加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
剩余固体的质量/g | 1 7.3 | n | 11.9 | … |
I以上数据可知,上表中n的值为___________;
II该金属粉末中Al的质量分数为___________%
【答案】延展 Fe BD 可以 2Al+ 3H2O =Al2O3+3H2↑ 固体减少,冒气泡 稀硫酸 固体减少,冒气泡,溶液变浅绿色 14.6 54%
【解析】
(1)铝箔铝块能制成铝箔利用了铝的延展性;
(2)Mg、Cu、Fe三种金属活动性由强到弱顺序是Mg、Fe、Cu,X所代表的金属可以与酸反应,但又不是特别剧烈,故为Fe;
(3)A、K2MnO4、KMnO4、MnO2中Mn元素的化合价分别为:+6、+7、+4,说法错误;
B、铜铁铝三种金属,最早被使用的是铜,铝最晚,正确;
C、三种物质中铜元素与另外元素的质量比分别为128:16、128:32、128:64,氧化亚铜中铜元素质量分数最大,说法错误;
D、地壳中元素含量前四位是氧、硅、铝、铁,故说法正确。
选BD。
(4)①既是反应物也是生成物的物质,可以循环使用,上述工艺流程中,铝镓(Ga)合金可以循环使用;
②铝镓合金与水反应得到氧化铝、氢气和镓,即镓未参加反应,实际上发生的反应是铝和水,生成物是氧化铝和氢气,方程式为:2Al+3H2O═Al2O3+3H2↑。
(5)①I.氢氧化钠不与铜、铁反应,与铝反应生成氢气,故现象为固体减少,冒气泡;
II.铝已经被除去,余下铁与铜,铁与稀硫酸反应生成浅绿色氯化亚铁溶液和氢气,铜与稀硫酸不反应。故可以加入稀硫酸,现象为固体减少,冒气泡,溶液变浅绿色;
②I.分析以上数据可知,第一次反应用去2.7克固体,第二次,也应反应掉2.7克,所以上表中n的值为14.6克;
II. 图中可知,该金属粉末中Al的质量分数为 ![]() ×100%=54%
×100%=54%

【题目】小强同学经过查阅资料得知:铝丝和铁丝一样,也能在氧气中燃烧,于是设计了如图所示的装置进行实验探究,请你结合实验过程回答下列问题。
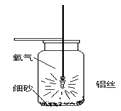
(1)集气瓶底预先铺少量沙子的目的是________。
(2)铝丝下端系一根火柴的目的是:________。
(3)用正确方法引燃铝丝,伸入装有氧气的集气瓶中后,未观察到铝丝发生剧烈燃烧现象,可能的原因是________。
(4)某化学兴趣小组的同学经查阅资料得知:人呼吸中各种气体的体积分数如表所示:
气体 | 吸入气体 | 呼出气体 |
X | 78% | 75% |
Y | 21% | 15% |
二氧化碳 | 0.03% | 3.68% |
水 | 0.02% | 5.44% |
其它 | 0.95% | 0.88% |
①请你判断:表中X是________,Y是________;
②欲证明人呼出的气体中含有水蒸气,其实验方法是___________。