题目内容
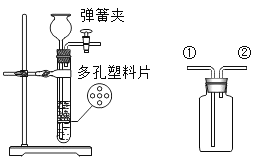
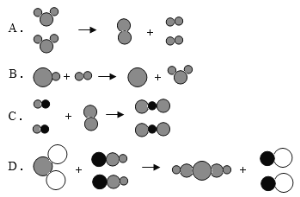
【题目】某研究小组为验证铁、铜、锌、银的金属活动顺序,设计如图所示三个实验(三种金属已用砂纸打磨过,其形状和大小相同,稀盐酸的浓度和用量也相同)。
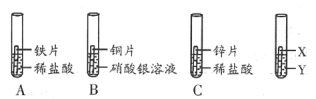
(1)实验前用砂纸打磨金属的目的是________________。
(2)一段时间后,观察到实验B的铜片表面有银白色固体附着,且溶液由无色变为______色,这说明铜比该金属活动性_______(填“强” 或“弱”),该反应的化学方程式为___________。
(3)甲同学认为通过实验A和C可比较锌和铁的金属活动性,他依据的实验现象是_________。
(4)乙同学认为仅仅通过上述实验不足以得出四种金属的活动性顺序,因此在上述实验的基础上,乙同学又补做了一个实验,装置如图所示,且实现了探究目的。乙同学的实验:X是金属______,Y是__________溶液。
【答案】除去金属表面的氧化物 蓝 强 ![]() 锌与盐酸反应产生的气泡的速率比铁快 Fe CuSO4
锌与盐酸反应产生的气泡的速率比铁快 Fe CuSO4
【解析】
(1)由于金属易与空其中的氧气反应在其表面形成了氧化物的薄膜,所以实验前用砂纸打磨金属的目的是除去金属表面的氧化物。
(2)由于铜与硝酸银反应生成了硝酸铜和银,所以一段时间后,观察到实验B的铜片表面有银白色固体附着,且溶液由无色变为蓝色,这说明铜比银的金属活动性强,该反应的化学方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag。
(3)锌和铁都与盐酸反应,锌反应的速率比铁快,实验现象是:锌与盐酸反应产生的气泡的速率比铁快。
(4)A能说明铁在氢的前面,B说明铜在银的前面,C说明锌在氢的前面,A、C说明锌在铁的前面,故通过A、B、C说明Zn>Fe>H,Cu>Ag,不能说明铁和铜的活动性,故可以通过金属与酸或金属与盐溶液的反应来证明铁和铜的活动性强弱,所以应选用的金属X是Fe;Y是CuSO4。

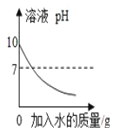
【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有________产生,反应的化学方程式是________________________________________________________。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
试管(盛有同体积同浓度的盐酸) | ① | ② | ③ | ④ |
镁条长度 | 1cm | 2cm | 3cm | 4cm |
相同的实验现象(省略题干现象) | 快速反应,试管发热,镁条全部消失 | |||
沉淀量差异(恢复至20℃) | 无 | 少量 | 较多 | 很多 |
[得出结论]镁条与盐酸反应产生白色沉淀与________有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是____________________(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | ________,白色沉淀________ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀________ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是: |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |